
| A、H2CO3=2 H++CO32- |
| B、Ca(OH)2=Ca2++(OH)2- |
| C、K2SO4═2K++SO4-2 |
| D、NaHCO3=Na++HCO3- |


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、p轨道中的未成对电子数:③>②>① |
| B、原子半径:③>②>① |
| C、电负性:③>①>② |
| D、最高正化合价:③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6g铁粉在2.24L氯气中充分燃烧,失去的电子数一定为0.3NA |
| B、标准状况下,15g一氧化氮和5.6L氧气混合后的分子总数为0.5NA |
| C、在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA |
| D、78gNa2S和Na2O2的混合物中含有的离子总数大于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在常温常压下,11.2LN2所含有的分子数为0.5NA |
| B、在标准状况下,22.4 L CO和N2的混合物的物质的量为1mol |
| C、在标准状况下,18g H2O的体积为22.4 L |
| D、1mol SO2的体积为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
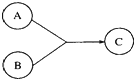 Ⅰ有机物A、B、C有如图所示转化关系,A的分子式为C3H4O2,A可与溴的四氯化碳溶液发生加成反应,1molA能与1molNaHCO3溶液恰好完全反应.B所含元素种类与A相同,是厨房的调味品,其中碳的质量分数为52.2%,氢的质量分数为13%.试回答下列问题,
Ⅰ有机物A、B、C有如图所示转化关系,A的分子式为C3H4O2,A可与溴的四氯化碳溶液发生加成反应,1molA能与1molNaHCO3溶液恰好完全反应.B所含元素种类与A相同,是厨房的调味品,其中碳的质量分数为52.2%,氢的质量分数为13%.试回答下列问题,
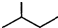 的名称为
的名称为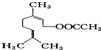
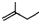
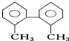 最多
最多查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl和NaOH反应的中和热△H=-57.3 kJ?mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ?mol-1 |
| B、CO(g)的燃烧热是283.0 kJ?mol-1,则2CO2(g)═2CO(g)+O2(g)△H=+2×283.0kJ?mol-1 |
| C、1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
| D、1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com