
【题目】某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2。为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:
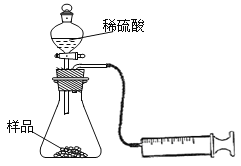
(1)在一个质量为a g的蒸发皿中加入一些样品,称得总质量为b g。用酒精灯对其充分加热,冷却后称得其总质量为c g。残留在蒸发皿中的固体是(填化学式)_______________。
(2)另称取相同质量的样品放入锥形瓶中,实验装置如右图所示。为了保证实验成功,所选用针筒的最大刻度值应大于或等于__________(mL)。(设实验在标准状况下进行)
(3)打开活塞逐滴加入稀硫酸,至没有气泡产生为止。针筒中收集到气体折算成标准状况下的体积为V mL(滴入稀硫酸的体积及针筒活塞的内壁的摩擦力忽略不计)。该科研小组设称取的每份样品中的Na2CO3、NaHCO3的物质的量分别为x、y,且没有利用化学方程式进行计算,就列出了如下算式:x + y = VmL/22400 mL·mol-1,他们依据的原理是___________。根据相似原理,请完成下列算式:2x + y =___________由上述两算式,该科研小组通过计算,得出了样品中的Na2CO3、NaHCO3的质量分数。
【答案】Na2CO3 (![]() +
+![]() )×22400 原子守恒
)×22400 原子守恒 ![]() ×2
×2
【解析】
(1)NaHCO3受热会发生如下反应:2NaHCO3![]() Na2CO3+CO2↑+ H2O,其中CO2气体,水都和离开反应体系,只剩下Na2CO3固体,则残留在蒸发皿中的固体是Na2CO3;
Na2CO3+CO2↑+ H2O,其中CO2气体,水都和离开反应体系,只剩下Na2CO3固体,则残留在蒸发皿中的固体是Na2CO3;
(2) 由(1)可知冷却后的总质量其实就是Na2CO3和蒸发皿质量,所以(c-a)就是Na2CO3质量,根据碳原子守恒,放出的CO2的物质的量为(c-a)÷106moL,在一个质量为a g的蒸发皿中加入一些样品,称得总质量为b g,用酒精灯对其充分加热,冷却后称得其总质量为c g,则(b-c)g是失去水和CO2的总质量,根据化学反应2NaHCO3![]() Na2CO3+CO2↑+H2O,水是液体,则CO2的物质的量为(b-c)÷62mol,所以所选用针筒的最大刻度值应大于或等于(
Na2CO3+CO2↑+H2O,水是液体,则CO2的物质的量为(b-c)÷62mol,所以所选用针筒的最大刻度值应大于或等于(![]() +
+![]() )×22400 mL;
)×22400 mL;
(3)根据题给方程可知,他们依据的原理是原子守恒;根据Na原子守恒可列方程2x+y=残留在蒸发皿中的固体中的Na,而固体质量为(c-a)g,钠原子的物质的量为(c-a)÷106×2,所以2x + y =![]() ×2。
×2。


科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是
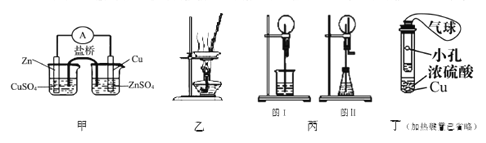
A. 甲装置构成铜锌原电池
B. 用图乙所示装量加热AlCl3饱和溶液然后利用余热蒸干制备AlCl3固体
C. 丙装置里图I烧瓶中充满氨气,烧杯中盛装水,在图II的锥形瓶中,加入足量的Cu与稀硝酸,图I和图II都产生喷泉现象且原理相同
D. 利用丁装置制取SO2,并检验其还原性,小试管中的试剂可为酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:25 ℃、101 kPa时,C(s)+1/2O2(g)=CO(g) ΔH1=-110.5 kJ/mol
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
试回答下列问题:
①碳的燃烧热是:__________(填“ΔH1”或“ΔH2”);
②CO(g)+1/2O2(g)=CO2(g) ΔH=__________kJ/mol。
(2)在25 ℃时,将0.2 mol NO2充入2 L的密闭容器中,发生反应:2NO2(g)![]() N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
①5秒内,v(NO2)=__________mol/(L·s);
②若将该容器置于冰水中,气体颜色将________(填“变深”“变浅”或“不变”);
③该反应的平衡常数表达式K=________________。
(3)NaHSO3是中学化学常见的物质。HSO3-在水溶液中存在如下两个平衡:
HSO3-=H++SO32- Ka2
HSO3-+H2O=H2SO3+OH- Kh2
已知25 ℃时,Ka2>Kh2,则0.1 mol/L NaHSO3溶液:
①溶液呈__________(填“酸性”“碱性”或“中性”);
②溶液中c(Na+)______c(HSO3-)(填“>”“<”或“=”)。
(4)将除锈后的铁钉用饱和食盐水浸泡一下,放入下图所示的具支试管中。

①几分钟后,可观察到导管中的水柱________;
A.升高 B.降低
②水柱变化的原因是铁钉发生了电化学腐蚀中的________;
A.析氢腐蚀 B.吸氧腐蚀
③该电化学腐蚀的正极反应式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以CaO和HNO3为原料制备Ca(NO3)26H2O晶体。为确保制备过程中既不补充水分,也无多余的水分,所用硝酸溶液中溶质的质量分数应为
A.53.8%B.58.3%C.60.3%D.70.0%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有0.6molCl-、0.8 molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响)。若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x。则
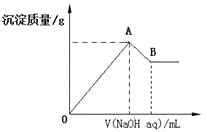
A.x=![]()
B.x的取值范围是0<x<11/32
C.A点横坐标的值随x发生变化
D.若B点横坐标为200mL时,c(NaOH)=7.0mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸在有机合成、医药化工、化纤等行业应用非常广泛。工业上用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2![]() 4NO+6H2O ----①
4NO+6H2O ----①
4NO+3O2+2H2O→4HNO3----②
完成下列计算:
52、如果以一定量的氨气在一密闭容器中与足量氧气发生上述反应,冷却后所得溶液中溶质的质量分数是_________________(保留2位小数,下同)。
53、现以1.70吨液氨为原料生产硝酸,然后加入4.50吨水,得到密度为1.31g/cm3的硝酸,该硝酸的物质的量浓度是_______mol/L(假设生产过程中反应物和生成物均无损耗)。
54、把22.40 g铁完全溶解于某浓度的硝酸中,反应只收集到 0.30 mol NO2 和0.20 mol NO。通过计算推断反应后溶液中溶质的成分及其物质的量__________(写出计算过程)。
55、硝酸工业尾气中的NO、NO2属于大气的主要污染物。已知1m3硝酸工业的尾气中含3160mg NOx,其中n(NO) : n(NO2) = 9:1。
(1)如果用NaOH溶液完全吸收NOx,至少需要补充标准状况下的富氧空气多少升?
_________________________(富氧空气中O2的体积分数为0.25)(写出计算过程)
(2)如果用氨催化还原法,即用氨作催化剂,将NO、NO2转化为氮气直接排入空气中,需要氨气的质量为多少克?__________________________(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种有机化合物的键线式如图所示。下列说法错误的是

A. 甲、乙的化学式均为C8H14
B. 乙的二氯代物共有7种(不考虑立体异构)
C. 丙的名称为乙苯,其分子中所有碳原子可能共平面
D. 甲、乙、丙均能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在新制氯水中滴加NaOH溶液,溶液中水电离出来的c水(H+)与 NaOH溶液的体积之间的关系如图所示。下列推断正确的是
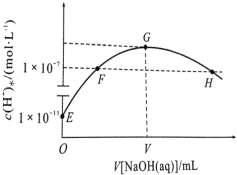
A.用 pH 试纸测定 E 点对应的溶液,其 pH=3
B.G 点对应的溶液中:c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+)
C.常温下加水稀释 H 点对应的溶液,溶液pH 减小
D.F、H 点对应的溶液中都存在:c(Na+) = c(Cl-) + c(ClO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作和现象 | 结论 |
A | 向NaBr溶液中分别滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | Br-的还原性强于Cl- |
B | 相同条件下,分别向20 mL 0.01 mol·L-1 KMnO4溶液和20 mL 0.05 mol·L-1 KMnO4溶液中滴加相同浓度和体积的草酸溶液(过量),0.05 mol·L-1的KMnO4溶液紫色褪色的时间更短(生成的Mn2+对该反应无影响) | 浓度对反应速率的影响:浓度越大,反应速率越快 |
C | 向淀粉碘化钾溶液中通入过量氯气,溶液由无色变为蓝色,后蓝色褪去 | 氯气具有强氧化性和漂白性 |
D | 室温下,用pH试纸测得0.1 mol·L-1 Na2SO3溶液的pH约为10,0.1 mol·L-1 NaHSO3溶液的pH约为5 | HS |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com