
【题目】下列装置或操作能达到实验目的的是
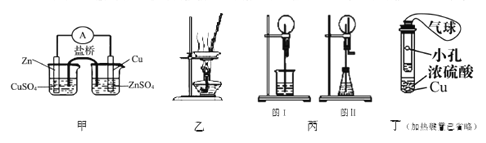
A. 甲装置构成铜锌原电池
B. 用图乙所示装量加热AlCl3饱和溶液然后利用余热蒸干制备AlCl3固体
C. 丙装置里图I烧瓶中充满氨气,烧杯中盛装水,在图II的锥形瓶中,加入足量的Cu与稀硝酸,图I和图II都产生喷泉现象且原理相同
D. 利用丁装置制取SO2,并检验其还原性,小试管中的试剂可为酸性KMnO4溶液
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加。A是元素Y的单质。常温下,甲的浓溶液和A发生钝化。丙、丁、戊是由这些元素组成的二元化合物,且丙是无色气体。上述物质的转化关系如图所示。下列说法正确的是
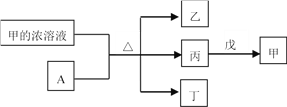
A. 丁和戊中所含元素种类相同
B. 简单离子半径大小:X<Y
C. 气态氢化物的还原性:X>Z
D. Y的简单离子与Z的简单离子在水溶液中可大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是自然界中形成化合物种类最多的元素,CO和CO2是碳的最常见氧化物。
(1)研究和解决二氧化碳捕集和转化问题是当前科学研究的前沿领域。在太阳能的作用下,缺铁氧化物[Fe0.9O]能分解CO2,其过程如图1所示。过程①的化学方程式是______。在过程②中每产生0.1molO2,转移电子______mol。

(2)在催化剂作用下,将二氧化碳和氢气混合反应生成甲烷,是目前科学家们正在探索的处理空气中的二氧化碳的方法之一。
①已知:
共价键 | C=O | H—H | C—H | O—H |
键能/(kJmol-1) | 745 | 436 | 413 | 463 |
则CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H=______kJmol-1。
CH4(g)+2H2O(g) △H=______kJmol-1。
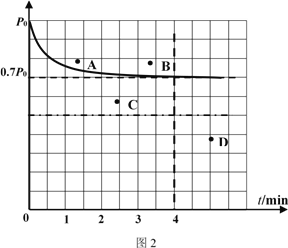
②向1L固定容积的密闭容器中加入4.0 mol H2(g)、1.0mol CO2,控制条件(催化剂:铑—镁合金、高温T1)使之反应,若测得容器内气体的压强随着时间的变化如图2所示。则4 min时容器内气体的密度为______;温度T1 下,该反应的化学平衡常为______。若采用2 L固定容积的密闭容器,投料量、催化剂和反应温度均保持不变,则反应重新达到平衡时对应体系内的压强的点是______(填字母)。
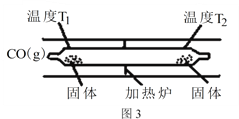
(3)工业合成原料气CO会与设备、管道及催化剂表面的金属铁、镍反应,生成羰基化合物。四羰基镍是热分解法制备高纯镍的原料,也是有机合成中供给一氧化碳的原料,还可做催化剂。Ni(s)+4CO(g)![]() Ni(CO)4(g) △H<0 Ni(CO)4(g)
Ni(CO)4(g) △H<0 Ni(CO)4(g)![]() Ni(s)+4CO(g)。如图3所示,在石英真空管的温度为T1一端,放入少量粗镍和CO(g),一段时间后,在温度为T2的一端可得到纯净的镍。则温度T1______T2(填“>”“<”或“=”),上述反应体系中循环使用的物质为______(填化学式)。
Ni(s)+4CO(g)。如图3所示,在石英真空管的温度为T1一端,放入少量粗镍和CO(g),一段时间后,在温度为T2的一端可得到纯净的镍。则温度T1______T2(填“>”“<”或“=”),上述反应体系中循环使用的物质为______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴的化合物在磁性材料生产、电池制造、催化剂制备等方面应用十分广泛。
(1)二价钴离子的核外电子排布式为______。基态Co原子核外3d能级上有______个未成对电子。Co与Ca属同周期,且核外最外层电子构型相同,但金属钴熔沸点都比钙高,原因是______。
(2)0.1mol[Co(NO2)6]3-中所含的σ键数目是______,K3[Co(NO2)6]中K、N、O三种元素的第一电离能由大到小的顺序是______。
(3)化合物四氨基钴酞菁分子的结构式如图。四氨基钴酞菁中N原子的杂化轨道类型为______。
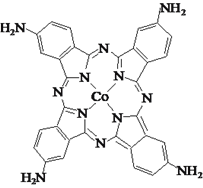
(4)[Co(NH3)6]Cl3晶体可由CoCl2溶于氨水并通入空气制得,该配合物中配体分子的立体构型是______。
(5)一种钴的化合物可用作石油脱硫的催化剂,其晶胞结构如图所示,则晶体中与每个O2-紧邻的O2-有______个,该钴的化合物的化学式是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:
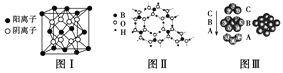
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中硼原子个数与极性键个数比为________。
(3)金属铜具有很好的延展性、导电传热性,对此现象最简单的解释是用________理论。
(4)三种晶体中熔点最低的是________,其晶体受热熔化时,克服的微粒之间的相互作用为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二醛是一种低级醛,它有着极其活跃的化学反应性,并有广泛的用途。
I.乙二醛的工业制法如下:
(1)乙醛(CH3CHO)液相硝酸氧化法
在Cu(NO3)催化下,用稀硝酸氧化乙醛制取乙二醛,反应的离子方程式为___________。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点是____________ 。
(2)乙二醇(HOCH2CH2OH)气相氧化法
①已知:OHC-CHO(g)+2H2(g)![]() HOCH2CH2OH(g) △H=-78kJ/mol K1
HOCH2CH2OH(g) △H=-78kJ/mol K1
2H2(g)+O2(g)![]() 2H2O(g) △H=-484kJ/mol K2
2H2O(g) △H=-484kJ/mol K2
乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g)![]() OHC-CHO(g)+2H2O(g)的相同温度下,该反应的化学平衡常数K=___(用含K1、K2的代数式表示)。
OHC-CHO(g)+2H2O(g)的相同温度下,该反应的化学平衡常数K=___(用含K1、K2的代数式表示)。
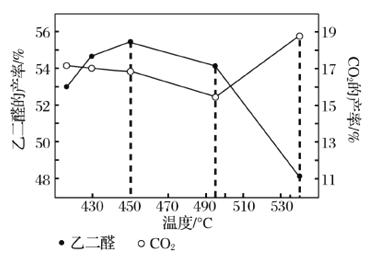
②当原料气中氧醇比为1.35时,乙二醛和副产物CO2的产率与反应温度的关系如图所示。反应温度在450~495℃之间和超过495℃时,乙二醛产率降低的主要原因分别是____、____。
II.乙二醛的用途之一是可以电解氧化制备乙醛酸(OHC-COOH),其生产装置如图所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸。
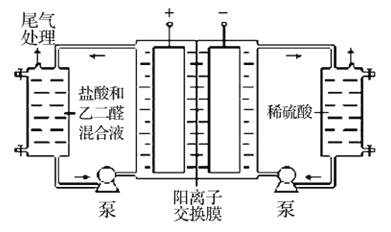
(3)阴极反应式为_________。
(4)阳极液中盐酸的作用,除了产生氯气外,还有__________作用。
(5)保持电流强度为aA,电解tmin,制得乙醛酸mg,列式表示该装置在本次电解中的电流效率η=__________ (已知:法拉第常数为fC·mol-l;![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某公司设计的用于驱动潜艇的液氨-液氧燃料电池示意图如下,有关说法正确的是
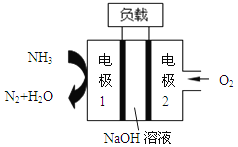
A. 电池总反应为:4NH3+3O2=2N2+6H2O
B. 电池工作时,OH-向正极移动
C. 电极 2 发生的电极反应为:O2+4H++4e-=2H2O
D. 电流由电极 1 经外电路流向电极2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Kb(NH3·H2O)=1.7×10-5,Ka(CH3COOH)=1.7×10-5。25℃时,向20mL浓度均为0.01mol·L-1的盐酸和醋酸的混合溶液中逐滴加入0.01mol·L-1的氨水,测定过程中电导率和pH变化曲线如图所示,下列说法错误的是
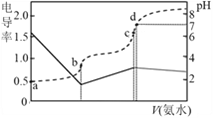
A. a点溶液中,c(CH3COO-)数量级约为10-5
B. b点溶液中,c(NH4+) > c(CH3COOH)
C. c点溶液中,c(NH4+) +c(NH3·H2O) = c(Cl-)+c(CH3COO-)+c(CH3COOH)
D. c点水的电离程度小于d点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com