
【题目】钴的化合物在磁性材料生产、电池制造、催化剂制备等方面应用十分广泛。
(1)二价钴离子的核外电子排布式为______。基态Co原子核外3d能级上有______个未成对电子。Co与Ca属同周期,且核外最外层电子构型相同,但金属钴熔沸点都比钙高,原因是______。
(2)0.1mol[Co(NO2)6]3-中所含的σ键数目是______,K3[Co(NO2)6]中K、N、O三种元素的第一电离能由大到小的顺序是______。
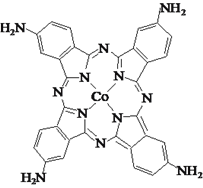
(3)化合物四氨基钴酞菁分子的结构式如图。四氨基钴酞菁中N原子的杂化轨道类型为______。
(4)[Co(NH3)6]Cl3晶体可由CoCl2溶于氨水并通入空气制得,该配合物中配体分子的立体构型是______。
(5)一种钴的化合物可用作石油脱硫的催化剂,其晶胞结构如图所示,则晶体中与每个O2-紧邻的O2-有______个,该钴的化合物的化学式是______。

【答案】 1s22s22p63s23p63d7或[Ar]3d7 3 钙原子半径较大且价电子数较少,金属键较弱 1.8NA N>O>K sp2、sp3 三角锥 8 CoTiO3
【解析】分析:(1)根据钴的原子序数结合核外电子排布规律解答;
(2)单键都是σ键,双键中含有1个σ键、1个π键;非金属性越强,第一电离能越大;
(3)根据氮原子的成键特点解答;
(4)配体是氨气,据此解答;
(5)根据晶胞结构结合均摊法计算。
详解:(1)钴的原子序数是27,则二价钴离子的核外电子排布式为1s22s22p63s23p63d7或[Ar]3d7。基态Co原子核外电子排布式为1s22s22p63s23p63d74s2,因此3d能级上有3个未成对电子。由于钙原子半径较大且价电子数较少,金属键较弱,因此金属钴的熔沸点都比钙的高。
(2)硝基中含有2个氮氧双键,另外[Co(NO2)6]3-中还含有配位键,一共含有18个σ键,则0.1mol[Co(NO2)6]3-中所含的σ键数目是1.8NA;非金属性越强,第一电离能越大,氮元素的2p轨道电子处于半充满状态,稳定性强,则K3[Co(NO2)6]中K、N、O三种元素的第一电离能由大到小的顺序是N>O>K。
(3)氨基中氮原子全部形成单键,属于sp3杂化;形成双键的氮原子是sp2杂化;
(4)[Co(NH3)6]Cl3中配体分子是氨气,氮原子的价层电子对数是4,其中氮原子含有一对孤对电子,其立体构型是三角锥形。
(5)O2-位于面心处,则晶体中与每个O2-紧邻的O2-有8个,钛原子个数8×1/8=1,氧原子个数是6×1/2=3,钴原子位于晶胞中,个数是1,因此该钴的化合物的化学式是CoTiO3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某温度下,将4molA和3molB充入体积为1L的密闭容器中,发生如下反应:aA(g)+2B(g)![]() 3C(g)+D(g)。反应达到平衡后,C的浓度为3mol/L.压缩容器体积,使容器的体积减小一半,建立新的平衡时,B的浓度为2mol/L.则方程式中a的数值为
3C(g)+D(g)。反应达到平衡后,C的浓度为3mol/L.压缩容器体积,使容器的体积减小一半,建立新的平衡时,B的浓度为2mol/L.则方程式中a的数值为
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
①电解池是将化学能转变为电能的装置
②原电池是将电能转变成化学能的装置
③不能自发进行的氧化还原反应,通过电解的原理有可能实现
④电镀过程相当于金属的“迁移”,可视为物理变化
A. ③B. ③④C. ②③④D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol O2在放电条件下发生下列反应:3O2![]() 2O3,如有30%O2转化为O3,则放电后混合气体对H2的相对密度是( )
2O3,如有30%O2转化为O3,则放电后混合气体对H2的相对密度是( )
A. 16 B. 17.8 C. 18.4 D. 35.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为__________。氧元素与氟元素能形成OF2分子,该分子的空间构型为__________。
(2)根据等电子体原理,在NO中氮原子轨道杂化类型是__________;1 mol O![]() 中含有的π键数目为__________个。
中含有的π键数目为__________个。
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr3+基态核外电子排布式为__________。
(4)下列物质的分子与O3分子的结构最相似的是__________。
A.H2O B.CO2 C.SO2 D.BeCl2
(5)O3分子是否为极性分子?__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是
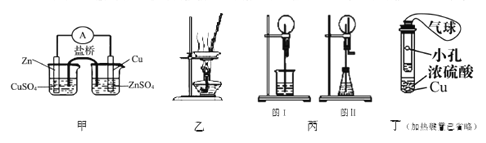
A. 甲装置构成铜锌原电池
B. 用图乙所示装量加热AlCl3饱和溶液然后利用余热蒸干制备AlCl3固体
C. 丙装置里图I烧瓶中充满氨气,烧杯中盛装水,在图II的锥形瓶中,加入足量的Cu与稀硝酸,图I和图II都产生喷泉现象且原理相同
D. 利用丁装置制取SO2,并检验其还原性,小试管中的试剂可为酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体具有规则的几何外形,晶体中最基本的重复单位称为晶胞。NaCl晶体结构如图所示。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1,测知FexO晶体密度ρ=5.71 g·cm-3,晶胞边长为4.28×10-10m。
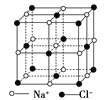
(1)FexO中x值(精确至0.01)为________。
(2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中,Fe2+所占分数(用小数表示,精确至0.001)为________。
(3)此晶体的化学式为________。
(4)与某个Fe2+(或Fe3+)距离最近且等距离的O2-围成的空间几何形状是________。
(5)在晶体中,铁离子间最短距离为________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中可以大量共存的是
A. pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
B. 加入Al放出H2的溶液中:SO42-、NH4+、Na+、F-
C. pH=7的溶液中:SO32-、Na+、K+、ClO—
D. 无色溶液中:K+、SO42-、Cu2+、Cl—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为有机物M、N、Q的转化关系,有关说法正确的是
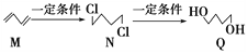
A. M生成N的反应类型是取代反应
B. N的同分异构体有6种
C. 可用酸性KMnO4溶液区分N与Q
D. 0.3 mol Q与足量金属钠反应生成6.72L H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com