
(8分)有一瓶澄清的溶液,其中可能含有NH4+、K+、 Ba2+、Al3+、Fe3+、 I-、NO3-、CO32-、SO42-、AlO2- 。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性。
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色。
③另取溶液适量,逐滴加入NaOH溶液:a.溶液从酸性变为中性;b.溶液逐渐产生沉淀;c.沉淀完全溶解;d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
④取适量③得到的碱性溶液加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题。
(1)由①可以排除 离子的存在。
(2)由②可以证明 离子的存在,同时排除 离子存在。理由是_________________________。
(3)由③可证明 离子存在。
(4)由④可以排除 离子存在,同时证明 离子的存在。
(1)CO32 -、AlO2-;
(2)I-;Fe3+、NO3-;因为CCl4层呈现出碘的颜色;Fe3+、NO3-在该环境中与I-不能共存。
(3)Al3+、NH4+;(4)SO42-;Ba2+。
解析试题分析:(1)①用pH试纸检验,溶液呈强酸性,则由于CO32-、AlO2- 与H+会发生离子而不能大量共存,因此CO32 -、AlO2-不能大量存在;(2)②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色证明在溶液中含有I-。由于I-、与Fe3+、NO3-、在酸性环境会发生氧化还原反应而不能大量存在,因此在证明I-存在的同时排除Fe3+、NO3-的存在;(3)③另取溶液适量,逐滴加入NaOH溶液:a.溶液从酸性变为中性;b.溶液逐渐产生沉淀;c.沉淀完全溶解; d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。证明含有Al3+、NH4+;(4)④取适量③得到的碱性溶液加入Na2CO3溶液,有白色沉淀生成。则证明在原溶液中含有Ba2+,由于SO42-在酸性环境也会形成沉淀,因此就可以排除SO42-离子的存在。
考点:考查离子的检验、离子共存的知识。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:单选题
下列反应的离子方程式正确的是
| A.向稀氨水中加入稀盐酸 OH- + H+ =H2O |
| B.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ |
| C.碳酸钙溶于醋酸中 CaCO3 + 2H+ =Ca2+ + H2O + CO2↑ |
| D.碳酸氢钙溶液跟稀硝酸反应 HCO3-+ H+ = H2O + CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
若溶液中由水电离产生的C (OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是:
| A.Al3+ Na+NO3- Cl- | B.K+ Na+Cl- NO3- |
| C.K+ Na+ Cl-AlO2- | D.K+ NH4+ SO42-NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。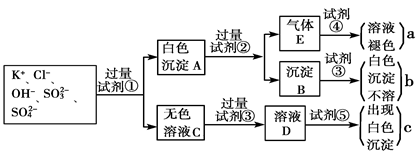
请回答下列问题:
(1)白色沉淀A与试剂②反应的离子方程式是__________________________________。
(2)无色溶液C中加入试剂③的主要目的是____________________________________。
(3)试验中若只加试剂③而不加试剂②,对实验的影响是_______________________。
(4)气体E通入试剂④发生反应的离子方程式是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)写出下列反应的离子方程式
(1)含少量NaHCO3的溶液与含过量Ba(OH)2的溶液混合: ;
(2)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式 ;
(3)硫酸铜溶液和氢氧化钡溶液混合
(4)用醋酸除去水壶中的水垢
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第 周期第 族;S的基态原子核外有 个未成对电子;Si的基态原子核外电子排布式为 。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si S | O2- Na+ | NaCl Si | H2SO4 HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)某科研小组设计出利用工业废酸(l0%)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,如下图所示。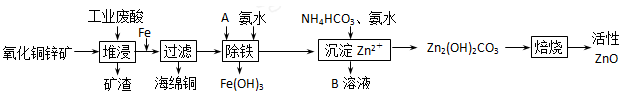
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。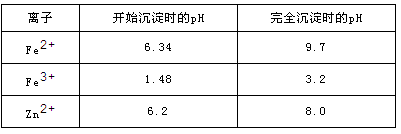
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS
不溶,则相同温度下:Ksp(CuS)______Ksp(ZnS)(选填“>”“<”或“=”)。
(2)物质A可使用下列物质中的 。
| A.KMnO4 | B.O2 | C.H2O2 | D.Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(17分)铁及其化合物在日常生活、生产中应用广泛。氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
请回答下列问题
(1)已知:①Fe2O3(s)+3C(石墨) 2Fe(s)+3CO(g)△H=+489.0KJ·mol
2Fe(s)+3CO(g)△H=+489.0KJ·mol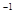 ;
;
②C(石墨)+CO2(g) 2CO(g)△H=+172.5KJ·mol
2CO(g)△H=+172.5KJ·mol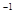 ;用赤铁矿为原料在高炉炼铁过程中发生的主要反应为Fe2O3(s)+3CO(g)
;用赤铁矿为原料在高炉炼铁过程中发生的主要反应为Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)△H= KJ·mol
2Fe(s)+3CO2(g)△H= KJ·mol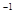 。
。
(2)吸收剂x的溶质为____________(写化学式)。
(3)氧化剂Y为“84消毒液”的有效成分,则在碱性条件下反应①的离子方程式为
__________________________________________________________________
(4)过程②是在某低温下进行的,反应的化学方程式为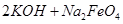 =
=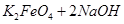 ,说明此温度下
,说明此温度下 __________
__________ 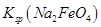 (填“>”或“<”)。
(填“>”或“<”)。
假定此过程中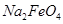 完全转化为
完全转化为 ,若最终制得粗产品
,若最终制得粗产品 206.25t,产品纯度为96%,则理论上至少需要氧化剂Y的质量是___________t。
206.25t,产品纯度为96%,则理论上至少需要氧化剂Y的质量是___________t。
(5)高铁电池是一种新型二次电池,电解液为强碱溶液,其电池反应为:3Zn+2K2FeO4+8H2O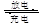 3Zn(OH)2+2Fe(OH)3+4KOH,放电时电池的负极反应式为______________________________________。
3Zn(OH)2+2Fe(OH)3+4KOH,放电时电池的负极反应式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置(部分夹持装置已略去):
(1)写出A中反应的离子方程式 。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式 。
(3)D中干燥管中出现的现象是 ,化学方程式 。
(4)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂 。
(5)还有什么方法能证明氧化性Cl2>S ,用一种相关事实说明 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com