
| A、1 L 0.1 mol?L-1 (NH4)2Fe(SO4)2?6H2O溶液中:c(NH4+)+c(Fe2+)+c(H+)=c(OH-)+c(SO42-) |
| B、0.1 mol?L-1的NH4Cl与0.1 mol?L-1的NH3?H2O等体积混合:c(NH4+)+2c(H+)=c(NH3?H2O)+2c(OH-) |
| C、pH=9.4、浓度均为0.1 mol?L-1的HCN与NaCN的混合溶液中:c(Na+)>c(CN-)>c(HCN)>c(OH-) |
| D、0.1 mol?L-1 CH3COONa 溶液与0.05 mol?L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
| A、硅胶吸附能力强,常用作催化剂载体和食品干燥剂 |
| B、福尔马林可用于保存海鲜产品 |
| C、天然纤维和合成纤维的主要成分都是纤维素 |
| D、工业上利用Cl2与澄清石灰水反应制取漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
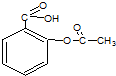
| A、该物质可以与氢气发生加成 |
| B、该物质能发生酯化反应 |
| C、该物质可水解生成水杨酸 |
| D、该物质极易溶于水和有机溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3?H2O其c(NH4+)由大到小的顺序是:①>②>③>④ |
| B、某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a |
| C、物质的量浓度相等的H2S、NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)? |
| D、AgCl悬浊液中存在平衡:AgCl(s)?Ag+(aq)+Cl- (aq),往其中加入少量NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
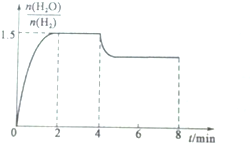
| n(H2O) |
| H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质析出,再加水也不溶解 |
| B、人工合成的具有生命活性的蛋白质-结晶牛胰岛素是1965年我国科学家最先合成的 |
| C、重金属盐能使蛋白质变性,所以误食重金属盐会中毒 |
| D、浓HNO3溅在皮肤上,使皮肤呈黄色,是由于浓HNO3和蛋白质发生颜色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuCl2+2NaOH═Cu(OH)2↓+2NaCl;Cu2++20H═Cu(OH)2↓ |
| B、BaSO4+2HCl═BaCl2+CO2↑+H2O;SO42-+2H+═CO2↑+H2O |
| C、Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3 Ca2++CO32-═CaCO3↓ |
| D、2KOH+H2SO4═K2SO4+2H2O;H++OH-═H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com