考点:离子浓度大小的比较,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:A.①NH4Al(SO4)2溶液中铝离子水解显酸性抑制铵根离子的水解,②NH4Cl溶液中氯离子不影响铵根离子水解,③CH3COONH4溶液中醋酸根水解显碱性,促进铵根离子的水解,④NH3?H2O溶液中存在电离平衡电离程度较小;
B.若a>7时,说明水的电离被抑制,酸或碱都能抑制水的电离,该溶液可能为酸性溶液,有可能为碱性溶液;
C.溶液中一定满足电荷守恒,根据混合液中的电荷守恒判断;
D.溶液中含有Na+离子,离子的总浓度增大.
解答:
解:A.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2溶液中铝离子水解显酸性抑制铵根离子的水解,②NH4Cl溶液中氯离子不影响铵根离子水解,③CH3COONH4溶液中醋酸根水解显碱性,促进铵根离子的水解,④NH3?H2O溶液中存在电离平衡电离程度较小,铵根离子浓度最小,所以铵根离子浓度大小顺序是:①>②>③>④,故A正确;
B.某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,说明水的电离被抑制,酸或碱都能抑制水的电离,所以溶液的pH可以是a,也可以是14-a,故B错误;
C.物质的量浓度相等的 H2S 和 NaHS 混合溶液中存在电荷守恒为:c (Na+)+c(H+)=2c (S2-)+c (HS-)+c (OH-),故C错误;
D.AgCl悬浊液中存在平衡:AgCl(s)?Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中含有Na+离子,离子的总浓度增大,故D错误;
故选A.
点评:本题考查较为综合,涉及离子浓度大小比较、盐类的水解原理及其应用、难溶电解质的溶解平衡等知识,侧重于学生的分析能力和基础知识的综合运用的考查,难度中等.



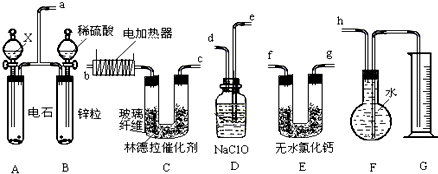
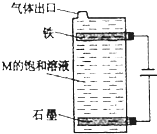 甲、乙、丙、丁、戊、己为原子序数依次增大的短周期主族元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,乙元素最高化合价与最低价的代数和为0;丙、丁、戊的最高价氧化物的水化物之间都能发生反应.用化学用语回答下列问题:
甲、乙、丙、丁、戊、己为原子序数依次增大的短周期主族元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,乙元素最高化合价与最低价的代数和为0;丙、丁、戊的最高价氧化物的水化物之间都能发生反应.用化学用语回答下列问题: