
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| A | 溴化钠溶液(NaI) | 氯水、CCl4 | 萃取、分液 |
| B | 氯化铵溶液(FeCl3) | 氢氧化钠溶液 | 过滤 |
| C | 二氧化氮(NO) | 氧气 | 通入过量O2 |
| D | 碳酸氢钠溶液(碳酸钠) | 二氧化碳 | 向溶液中通入过量CO2 |
| A、A | B、B | C、C | D、D |


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
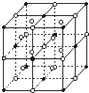 A、B、C、D是短周期元素,它们的离子具有相同的电子层结构,且半径依次减小.A与D的化合物X既能与盐酸反应,又能与NaOH溶液反应;B、C组成典型的离子化合物Y,其晶体结构类似于NaCl晶体;A与C以原子个数之比1:1组成化合物Z.
A、B、C、D是短周期元素,它们的离子具有相同的电子层结构,且半径依次减小.A与D的化合物X既能与盐酸反应,又能与NaOH溶液反应;B、C组成典型的离子化合物Y,其晶体结构类似于NaCl晶体;A与C以原子个数之比1:1组成化合物Z.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
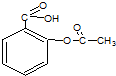
| A、该物质可以与氢气发生加成 |
| B、该物质能发生酯化反应 |
| C、该物质可水解生成水杨酸 |
| D、该物质极易溶于水和有机溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定 次数 | 样品的质量/g | 稀盐酸的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.320 0 | 1.02 | 21.03 |
| 2 | 0.320 0 | 2.00 | 21.99 |
| 3 | 0.320 0 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3?H2O其c(NH4+)由大到小的顺序是:①>②>③>④ |
| B、某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a |
| C、物质的量浓度相等的H2S、NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)? |
| D、AgCl悬浊液中存在平衡:AgCl(s)?Ag+(aq)+Cl- (aq),往其中加入少量NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
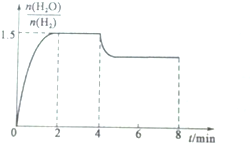
| n(H2O) |
| H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③④ |
| C、①③④ | D、①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com