
| A、①② | B、②③④ |
| C、①③④ | D、①②③④ |
科目:高中化学 来源: 题型:
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| A | 溴化钠溶液(NaI) | 氯水、CCl4 | 萃取、分液 |
| B | 氯化铵溶液(FeCl3) | 氢氧化钠溶液 | 过滤 |
| C | 二氧化氮(NO) | 氧气 | 通入过量O2 |
| D | 碳酸氢钠溶液(碳酸钠) | 二氧化碳 | 向溶液中通入过量CO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3?H2O | ||||
| B、Na2O2加入H218O中:2Na2O2+2H218O=4Na++4OH-+18O2↑ | ||||
C、NH4HCO3溶液与过量NaOH溶液共热:NH4++OH-
| ||||
D、浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
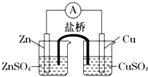
| A、锌是电池的负极,发生还原反应 |
| B、盐桥中的阳离子向硫酸铜溶液中迁移 |
| C、电流从锌电极通过检流计流向铜电极 |
| D、铜电极上发生的电极反应是2H++e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同浓度的两溶液中由水电离出的c(H+)相同 |
| B、pH=12与pH=2的两溶液稀释100倍,pH都变化2个单位 |
| C、用20mL0.1mol/L的氢氧化钠滴定未知浓度的醋酸,选用酚酞作指示剂 |
| D、两溶液相互反应生成1molH2O的中和热为57.3kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
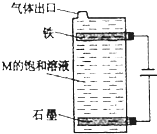 甲、乙、丙、丁、戊、己为原子序数依次增大的短周期主族元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,乙元素最高化合价与最低价的代数和为0;丙、丁、戊的最高价氧化物的水化物之间都能发生反应.用化学用语回答下列问题:
甲、乙、丙、丁、戊、己为原子序数依次增大的短周期主族元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,乙元素最高化合价与最低价的代数和为0;丙、丁、戊的最高价氧化物的水化物之间都能发生反应.用化学用语回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2:3 |
| B、6:3:2 |
| C、3:2:2 |
| D、3:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
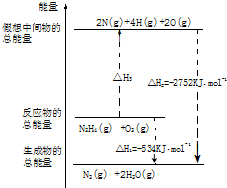 氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com