
| A、0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3?H2O | ||||
| B、Na2O2加入H218O中:2Na2O2+2H218O=4Na++4OH-+18O2↑ | ||||
C、NH4HCO3溶液与过量NaOH溶液共热:NH4++OH-
| ||||
D、浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+
|
| ||
| ||


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
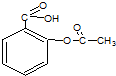
| A、该物质可以与氢气发生加成 |
| B、该物质能发生酯化反应 |
| C、该物质可水解生成水杨酸 |
| D、该物质极易溶于水和有机溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
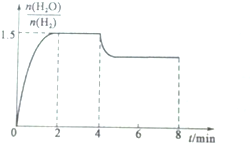
| n(H2O) |
| H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质析出,再加水也不溶解 |
| B、人工合成的具有生命活性的蛋白质-结晶牛胰岛素是1965年我国科学家最先合成的 |
| C、重金属盐能使蛋白质变性,所以误食重金属盐会中毒 |
| D、浓HNO3溅在皮肤上,使皮肤呈黄色,是由于浓HNO3和蛋白质发生颜色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A、A、保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol?L-1,则反应的△H<0 |
| B、若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变 |
| C、保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,反应达到平衡前的速率:v(正)<v(逆) |
| D、保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B、用锌片做阳极,铁片做阴极,电解氯化铜溶液,铁片表面析出铜 |
| C、把铜片插入三氯化铁溶液,在铜片表面析出铁 |
| D、把锌放入稀盐酸中,加几滴氯化铜溶液,产生气泡速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③④ |
| C、①③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuCl2+2NaOH═Cu(OH)2↓+2NaCl;Cu2++20H═Cu(OH)2↓ |
| B、BaSO4+2HCl═BaCl2+CO2↑+H2O;SO42-+2H+═CO2↑+H2O |
| C、Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3 Ca2++CO32-═CaCO3↓ |
| D、2KOH+H2SO4═K2SO4+2H2O;H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,8gO2和O3的混合物含有2AA个电子 |
| B、29gC4H10中含有的共价键个数为13NA |
| C、1L1 moI?L-1的NaClO溶液中含有ClO的数日为NA |
| D、标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com