
氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用。
(1)一定温度下,在1L容积恒定的密闭容器中充入2 mol N2和8molH2并发生反应。10min达平衡,测得氨气的浓度为0.4 mol·L-1,此时氮气的转化率为________。若想提高氨气的产率,根据化学平衡移动原理,提出合理的建议______________(写出一条即可)。
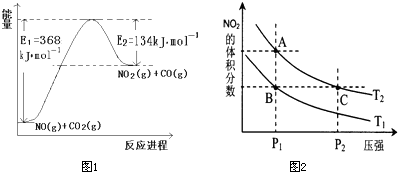
(2)如图是1mol NO2(g)和1mol CO(g)反应生成lmol CO2(g)和1 mol NO(g)过程中能量变化示意图,请写出该反应的热化学方程式_____________________。

(3)在容积恒定的密闭容器中,进行如下反应:N2(g)+3H2(g) 2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:

①该反应的平衡常数表达式:K=_____________;
②试判断K1__________K2(填写“>”“=”或“<”);
③NH3(g)燃烧的方程式为:4NH3(g)+7O2(g)=4NO2(g)+6H2O(l),已知:
①2H2(g)+O2(g) 2H2O(l) △H=-483.6 kJ/mol
2H2O(l) △H=-483.6 kJ/mol
②N2(g)+2O2(g) 2NO2(g) △H=+67.8 kJ/mol
2NO2(g) △H=+67.8 kJ/mol
③N2(g)+3H2(g) 2NH3(g) △H=-92.0 kJ/mol
2NH3(g) △H=-92.0 kJ/mol
请计算NH3(g)的燃烧热________kJ/mol。
(1)10%;增大反应物的浓度、降温、增大压强等;
(2)NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ/mol;
(3)①K=c2(NH3)/ c(N2) c3(H2);②>;③282.8
【解析】
试题分析:(1)根据题意知,平衡时氨气的物质的量为0.4mol,根据N2(g)+3H2(g) 2NH3(g)知,转化的氮气的物质的量为0.2mol,氮气的转化率为10%;若想提高氨气的产率,根据化学平衡移动原理,提出合理的建议:增大反应物的浓度、降温、增大压强等;(2)由题给图像知,该反应的焓变△H=E1—E2=134KJ/mol—368KJ/mol=—234KJ/mol,热化学方程式为NO2(g)+CO(g)=CO2(g)+NO(g)△H=—234
kJ/mol,(3)①根据化学平衡常数的定义写出,K=c2(NH3)/ c(N2)
c3(H2);②合成氨的反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,所以K1>K2;③根据盖斯定律:①×3+②×2—③×2得,4NH3(g)+7O2(g)=4NO2(g)+6H2O(l),△H=—1131.2 kJ/mol,结合燃烧热的定义知,NH3(g)的燃烧热282.8kJ/mol。
2NH3(g)知,转化的氮气的物质的量为0.2mol,氮气的转化率为10%;若想提高氨气的产率,根据化学平衡移动原理,提出合理的建议:增大反应物的浓度、降温、增大压强等;(2)由题给图像知,该反应的焓变△H=E1—E2=134KJ/mol—368KJ/mol=—234KJ/mol,热化学方程式为NO2(g)+CO(g)=CO2(g)+NO(g)△H=—234
kJ/mol,(3)①根据化学平衡常数的定义写出,K=c2(NH3)/ c(N2)
c3(H2);②合成氨的反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,所以K1>K2;③根据盖斯定律:①×3+②×2—③×2得,4NH3(g)+7O2(g)=4NO2(g)+6H2O(l),△H=—1131.2 kJ/mol,结合燃烧热的定义知,NH3(g)的燃烧热282.8kJ/mol。
考点:考查化学平衡计算、平衡移动原理、化学平衡常数及影响因素、热化学方程式的书写及燃烧热的概念。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:阅读理解
 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.| 1 |
| 2 |
| 3 |
| 2 |
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| 催化剂 |
| 高温高压 |
| 容器 编号 |
起始时各物质的物质的量/mol | 反应达平衡时的焓变/kJ?mol-1 | ||
| N2 | H2 | NH3 | ||
| A | 1 | 3 | 0 | △H1=-23.1 |
| B | 0.9 | 2.7 | 0.2 | △H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| 高温 |
| ||
| 高温 |
| 4 |
| 7 |
| ||
| 高温 |
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| T/K | 298 | 398 | 498 |
| 平衡常数K | 2.44ⅹ10-6 | K1 | K2 |
| 9 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/(K) | 298 | 398 | 498 | … |
| K/(mol?L-1)-2 | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 催化剂 |
| 高温高压 |
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com