
【题目】苯、甲苯都是重要的有机化工原料,能生产许多有机物,如通过苯可生产苯酚、硝基苯、氯苯、苯乙烯等。
(1)下列各组物质中,不能用酸性KMnO4溶液鉴别的是______(填字母)。
a 苯和甲苯 b 苯和己烷 c 乙烯和苯 d 乙烯和乙炔
(2)在苯甲醛分子中能共平面的原子最多有______个。一定条件下,1 mol苯甲醛与足量的新制Cu(OH)2充分反应,生成Cu2O的物质的量为______mol。
(3)以苯为主要原料制取苯乙烯的合成路线流程图可表示如下:

①B中含氧官能团的名称是______。
②A、B、C、D中含有手性碳原子的是______(填字母)。
③写出C与甲酸反应生成相应酯的化学方程式:______。
【答案】bd 14 1 羰基 C  +HCOOH
+HCOOH![]()
![]() +H2O
+H2O
【解析】
⑴a选项,苯不能使酸性高锰酸钾溶液褪色,甲苯能使酸性高锰酸钾溶液褪色,两者能鉴别,故a正确;
b选项,苯不能使酸性高锰酸钾溶液褪色,己烷不能使酸性高锰酸钾溶液褪色,两者不能鉴别,故b错误;
c选项,乙烯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色,两者能鉴别,故c正确;
d选项,乙烯能使酸性高锰酸钾溶液褪色,乙炔能使酸性高锰酸钾溶液褪色,两者不能鉴别,故d错误;
综上所述,答案为:bd;
⑵在苯甲醛![]() 中—C6H5、—CHO都在同一平面内,两个平面旋转,因此分子中所有原子都能共平面,分子中共平面的原子最多有14个,一定条件下,根据方程式关系得出,1 mol苯甲醛与足量的新制Cu(OH)2充分反应,生成Cu2O的物质的量为1 mol,故答案为:14;1;
中—C6H5、—CHO都在同一平面内,两个平面旋转,因此分子中所有原子都能共平面,分子中共平面的原子最多有14个,一定条件下,根据方程式关系得出,1 mol苯甲醛与足量的新制Cu(OH)2充分反应,生成Cu2O的物质的量为1 mol,故答案为:14;1;
⑶①B中含氧官能团的名称是羰基,故答案为:羰基;
②手性碳原子是碳原子连的四个原子或原子团都不相同,因此C(![]() )中的*号碳原子为手性碳原子,故答案为:C;
)中的*号碳原子为手性碳原子,故答案为:C;
③写出C与甲酸反应生成相应酯的化学方程式 +HCOOH
+HCOOH![]()
![]() +H2O,故答案为:
+H2O,故答案为: +HCOOH
+HCOOH![]()
![]() +H2O。
+H2O。


科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g),在一个可变容积的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g),在一个可变容积的密闭容器中进行,试回答:
(1)增加Fe的量,其反应速率的变化是___(填“增大”“不变”或“减小”)。
(2)增加H2O的量,其反应速率__(填“增大”“不变”或“减小”)。
(3)将容器的体积缩小一半,其反应速率__(填“增大”“不变”或“减小”)。
(4)保持体积不变,充入N2使体系压强增大,其反应速率___。(填“增大”“不变”或“减小”)。
(5)保持压强不变,充入N2使容器的体积增大,其反应速率___(填“增大”“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究Mg与NaHCO3溶液反应的机理,做了如下探究。
实验一:
实验A | 实验B | |
操作 | 在注射器中加入过量镁片(擦去表面氧化膜),吸入15mL饱和NaHCO3溶液。 | 在注射器中加入过量镁片(擦去表面氧化膜),吸入15mL蒸馏水。 |
现象 | 有气体产生,20min后注射器内壁和底部产生大量白色沉淀 | 缓慢产生气体 |
(1)实验B的目的是___。
实验二:
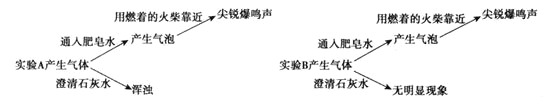
(2)根据实验二,实验A中产生的气体是___。(填分子式)
实验三:分别取少量实验A和B的上层清液于两支试管中,各加入2滴BaCl2溶液,A中立即产生白色沉淀,B中无明显现象。
(3)实验三说明Mg与NaHCO3溶液反应产生了___(填离子符号)。
实验四:该小组同学对实验A中产生的白色沉淀做出如下猜测:并用图所示装置进行实验,进一步确定白色沉淀的成分。

猜测1:白色不溶物可能为Mg(OH)2
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2xMgCO3]
(4)若用装置A、B组合进行实验,B中有白色浑浊,则猜想___不正确;将装置按A、C、B的顺序组合进行实验,当出现___现象时,猜想3是正确的。
实验五:用图所示装置测定碱式碳酸镁[yMg(OH)2xMgCO3]的组成:
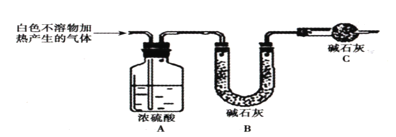
(5)称取干燥、纯净的白色不溶物7.36g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.72g,装置B增重2.64g。装置C的作用是___,白色不溶物的化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是一种重要的化工原料,可由H2与CO或CO2反应制备,主要用于制备羧基甲酯等。
(1)水杨酸甲酯是无色透明油状液体,密度为1.54g·cm-3,常作为医药制剂的赋香剂。制备及提纯水杨酸甲酯的实验步骤如下:
步骤1.在三口烧瓶中加入3.5g(0.025mol)水杨酸 、15mL(0.375mol)甲醇、1mL浓硫酸,几粒沸石,在85~95℃加热回流1.5h(装置如图所示)。
、15mL(0.375mol)甲醇、1mL浓硫酸,几粒沸石,在85~95℃加热回流1.5h(装置如图所示)。

步骤2.向回收甲醇后剩余液中加入10mL水,振荡、静置,分液出有机相。
步骤3.有机相依次用水、10%Na2CO3溶液、水洗涤。
步骤4.干燥,蒸馏并收集221~224℃馏分。
①图中仪器W的名称是___。
②步骤3,第一次水洗的主要目的是___;第二次水洗的目的是___。
③合成水杨酸甲酯的化学方程式为___;实验中加入过量甲醇的目的是___。
(2)工业上制备甲醇的主要反应有:
(Ⅰ)CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1 平衡常数K1
CH3OH(g)+H2O(g) ΔH1 平衡常数K1
(Ⅱ)CO(g)+2H2(g)![]() CH3OH(g) ΔH2 平衡常数K2
CH3OH(g) ΔH2 平衡常数K2
(Ⅲ)CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3 平衡常数K3
CO(g)+H2O(g) ΔH3 平衡常数K3
维持![]() =75:25,CO、CO2以及n(CO2):n(CO)=1:2,用不同催化剂时甲醇的产率随温度的变化如图所示:
=75:25,CO、CO2以及n(CO2):n(CO)=1:2,用不同催化剂时甲醇的产率随温度的变化如图所示:

①平衡常数K3=___(用K1、K2表示);△H1___0(填“>"或“<”)。
②下列叙述正确的是___ (填标号)。
A.催化剂Cu/ZnO不能催化反应(I)
B.催化剂Cu/ZnO在温度低于480K时活性很低
C.图中a点所示条件下,延长反应时间能提高甲醇的产率
D.图中b点所示条件下,若增加H2的浓度不能提高甲醇的产率
③400K时向某恒容密闭容器中充入CO和H2,使c(CO)=0.10mol·L-1,c(H2)=0.20mol·L-1,且只发生反应(II);平衡时c(CH3OH)=0.08mol·L-1。该温度下反应(II)的平衡常数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某固体有机物![]() 的分子组成,测定装置图所示(夹持仪器、酒精灯等已略去)。
的分子组成,测定装置图所示(夹持仪器、酒精灯等已略去)。

取![]() 放入装置中,通入过量
放入装置中,通入过量![]() 燃烧,生成
燃烧,生成![]() 和
和![]() ,请回答下列有关问题:
,请回答下列有关问题:
(1)通入过量![]() 的目的是_________。
的目的是_________。
(2)![]() 装置的作用是________________,
装置的作用是________________,![]() 装置的作用是___________。
装置的作用是___________。
(3)通过该实验能否确定![]() 中是否含有氧原子________(填“能”或“不能”)。
中是否含有氧原子________(填“能”或“不能”)。
(4)若![]() 的摩尔质量为
的摩尔质量为![]() ,
,![]() 装置增重
装置增重![]() ,
,![]() 装置增重
装置增重![]() ,则
,则![]() 的分子式为________。
的分子式为________。
(5)写出![]() 燃烧的化学方程式:________________。
燃烧的化学方程式:________________。
(6)![]() 可发生水解反应,
可发生水解反应,![]() 可水解生成2种互为同分异构体的产物,且这两种产物均为
可水解生成2种互为同分异构体的产物,且这两种产物均为![]() ,则
,则![]() 在催化剂作用下水解的化学方程式为_____。
在催化剂作用下水解的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯甲酸的酸性比碳酸强,苯酚的酸性比碳酸弱。则可将 转变为
转变为 的方法是( )
的方法是( )
①与足量的NaOH溶液共热,再通入CO2 ②与稀硫酸共热后,加入足量的NaOH溶液 ③加热溶液,通入足量的SO2 ④与稀H2SO4共热后,加入足量的NaHCO3
A.①②
B.①④
C.②③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】数十年来,化学工作者对碳的氧化物和氢化物做了广泛深入的研究并取得了一些重要成果。已知:C(s)+O2(g)=CO2(g);ΔH=-393 kJ·mol-1
2CO (g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(g);ΔH=-484 kJ·mol-1
(1)工业上常采用将水蒸气喷到灼热的炭层上实现煤的气化(制得CO、H2),该反应的热化学方程式是_______________。
(2)上述煤气化过程中需向炭层交替喷入空气和水蒸气,喷入空气的目的是__________;该气化气可在加热和催化剂下合成液体燃料甲醇,该反应方程式为_______________。
(3)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) === HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) === CH3OH(g) +CO(g) △H>0
则以甲醇制一氧化碳的反应为___________反应(填“吸热”、“放热”)。
(4)科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以
CO2和H2O合成CH4。
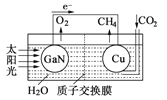
①写出铜电极表面的电极反应式____________。
②为提高该人工光合系统的工作效率,可向装置中加入少量___________(选填“氢氧化钠”或“硫酸”)。
(5)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X。由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图,则X的结构简式为_____________。
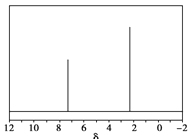
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇( )广泛存在于食物(例如桑葚、花生,尤其是葡萄)中,它可能具有抗癌性。回答下列问题:
)广泛存在于食物(例如桑葚、花生,尤其是葡萄)中,它可能具有抗癌性。回答下列问题:
(1)关于它的说法正确的是________。
a.可使酸性KMnO4溶液褪色
b.可与FeCl3溶液作用显紫色
c.可使溴的CCl4溶液褪色
d.可与NH4HCO3溶液作用产生气泡
e.它属于醇类
(2)1 mol 该化合物最多消耗________ mol NaOH。
(3)1 mol 该化合物与Br2反应时,最多消耗________ mol Br2。
(4)1 mol该化合物与H2加成时,最多消耗标准状况下的H2的体积为________ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙烯的装置如下图所示,请根据图示回答下列问题:

(1)实验室制乙烯的化学方程式为_____在这个反应中,浓硫酸的作用是_____________________和______________。
(2)某化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫, 老师启发他们并由他们自己设计了下列实验图以确认上述混合气体中有 C2H4 和 SO2。
回答下列问题:

品红溶液 NaOH 溶液 品红溶液酸性KMnO4 溶液
①能说明 SO2 气体存在的现象是____________________。
②确定含有乙烯的现象是_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com