
����Ŀ���״�(CH3OH)��һ����Ҫ�Ļ���ԭ�ϣ�����H2��CO��CO2��Ӧ�Ʊ�����Ҫ�����Ʊ��Ȼ������ȡ�
(1)ˮ�����������ɫ����״Һ�壬�ܶ�Ϊ1.54g��cm-3������Ϊҽҩ�Ƽ��ĸ�������Ʊ����ᴿˮ���������ʵ�鲽�����£�
����1.��������ƿ�м���3.5g(0.025mol)ˮ���� ��15mL(0.375mol)�״���1mLŨ���ᣬ������ʯ����85~95�����Ȼ���1.5h(װ����ͼ��ʾ)��
��15mL(0.375mol)�״���1mLŨ���ᣬ������ʯ����85~95�����Ȼ���1.5h(װ����ͼ��ʾ)��

����2.����ռ״���ʣ��Һ�м���10mLˮ�������ã���Һ���л��ࡣ
����3.�л���������ˮ��10%Na2CO3��Һ��ˮϴ�ӡ�
����4.��������ռ�221~224����֡�
��ͼ������W��������___��
������3����һ��ˮϴ����ҪĿ����___���ڶ���ˮϴ��Ŀ����___��
���ϳ�ˮ��������Ļ�ѧ����ʽΪ___��ʵ���м�������״���Ŀ����___��
(2)��ҵ���Ʊ��״�����Ҫ��Ӧ�У�
(��)CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H1 ƽ�ⳣ��K1
CH3OH(g)+H2O(g) ��H1 ƽ�ⳣ��K1
(��)CO(g)+2H2(g)![]() CH3OH(g) ��H2 ƽ�ⳣ��K2
CH3OH(g) ��H2 ƽ�ⳣ��K2
(��)CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H3 ƽ�ⳣ��K3
CO(g)+H2O(g) ��H3 ƽ�ⳣ��K3
ά��![]() =75��25��CO��CO2�Լ�n(CO2)��n(CO)=1��2���ò�ͬ����ʱ�״��IJ������¶ȵı仯��ͼ��ʾ��
=75��25��CO��CO2�Լ�n(CO2)��n(CO)=1��2���ò�ͬ����ʱ�״��IJ������¶ȵı仯��ͼ��ʾ��

��ƽ�ⳣ��K3=___(��K1��K2��ʾ)����H1___0(����>"����<��)��
������������ȷ����___ (����)��
A.����Cu/ZnO���ܴ���Ӧ(I)
B.����Cu/ZnO���¶ȵ���480Kʱ���Ժܵ�
C.ͼ��a����ʾ�����£��ӳ���Ӧʱ������״��IJ���
D.ͼ��b����ʾ�����£�������H2��Ũ�Ȳ�����״��IJ���
��400Kʱ��ij�����ܱ������г���CO��H2��ʹc(CO)=0.10mol��L-1��c(H2)=0.20mol��L-1����ֻ������Ӧ(II)��ƽ��ʱc(CH3OH)=0.08mol��L-1�����¶��·�Ӧ(II)��ƽ�ⳣ��Ϊ___��
���𰸡����������� ��ȥ�ֵ�ˮ��������� ��ȥNa2CO3��ˮ�����Ƶ��� 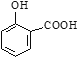 +CH3OH
+CH3OH +H2O ���ˮ�����(ƽ��)ת����
+H2O ���ˮ�����(ƽ��)ת���� ![]() �� BC 2.5��103
�� BC 2.5��103
��������
(1) ����װ�õĽṹ�ص��֪��WΪ���������ܣ��ʴ�Ϊ�����������ܣ�
�ڷ�Ӧ�����ҺҪ�������ϴ�ӣ���ϴ�Ӳ����У���һ��ˮϴ����ҪĿ���dz�ȥ�ִ��������δ��Ӧ���ˮ���ᣬ10%Na2CO3��Һ�ȿ��Գ�ȥδϴ�������ᣬҲ���Խ��������ܽ�ȣ����ڶ���ϴ�Ӻ����ɵ����л���Na2CO3�����Եڶ���ˮϴ����ҪĿ���dz�ȥ��Ʒ�в�����Na2CO3��ˮ�����Ƶ��Σ�
�ʴ�Ϊ����ȥ�ֵ�ˮ����������ȥNa2CO3��ˮ�����Ƶ��Σ�
��ˮ�����������ˮ����ͼ״�������Ӧ�õ�����ӦΪ�� +CH3OH
+CH3OH![]()
 +H2O��ʵ���м״������������������ˮ�����(ƽ��)ת���ʣ�
+H2O��ʵ���м״������������������ˮ�����(ƽ��)ת���ʣ�
�ʴ�Ϊ�� +CH3OH
+CH3OH![]()
 +H2O�����ˮ�����(ƽ��)ת���ʣ�
+H2O�����ˮ�����(ƽ��)ת���ʣ�
(2) ���ɸ�˹���ɿ�֪(��)= (I) -(II)����K3=![]() ����ͼ��ɵã����¶ȵ����ߣ��״��IJ�����С��˵������ƽ�������ƶ�������Ϊ���ȷ���������Ϊ���ȷ�Ӧ����H1<0��
����ͼ��ɵã����¶ȵ����ߣ��״��IJ�����С��˵������ƽ�������ƶ�������Ϊ���ȷ���������Ϊ���ȷ�Ӧ����H1<0��
�ʴ�Ϊ��![]() ��<��
��<��
��A.��ͼ���֪�Ӵ���Cu/ZnO�����¶ȵ����߷�Ӧ(I)�м״��IJ���������˴���Cu/ZnO�ܴ���Ӧ(I)����A����
B.��ͼ��֪����Cu/ZnO���¶ȵ���480Kʱ�Լ״��IJ��ʼ���û��Ӱ�죬˵���¶ȵ�ʱ����Ժܵͣ���B��ȷ��
C.ͼ��a����ʾ�����£���Ӧδ�ﵽƽ��״̬����ͼ��֪��ӦӦ������״����ʵķ�����У�����Ӧ��������дﵽƽ��״̬������ӳ���Ӧʱ������״��IJ��ʣ���C��ȷ��
D.ͼ��b����ʾ�����£�������H2��Ũ�Ȼ�ʹƽ�������ƶ���������״��IJ��ʣ���D����
�ʴ�Ϊ��BC��
��400Kʱ��ij�����ܱ������г���CO��H2��ʹc(CO)=0.10mol��L-1��c(H2)=0.20mol��L-1��ƽ��ʱc(CH3OH)=0.08mol��L-1�г�����ʽ���£�
��CO�ı仯Ũ��Ϊxmol/L
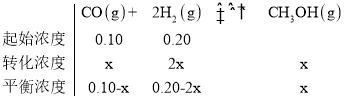
����֪�ã�x=0.08mol��L-1����ƽ��ʱc(CO)=0.02mol��L-1��c(H2)=0.04mol��L-1��
���¶��·�Ӧ(II)��ƽ�ⳣ��ΪK=![]() =2.5��103��
=2.5��103��
�ʴ�Ϊ��2.5��103��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǵ�3����11��17��Ԫ��ijЩ���ʱ仯���Ƶ�����ͼ�������й�˵������ȷ����(����)
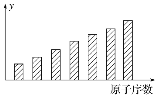
A.y���ʾ�Ŀ����ǵ�����B.y���ʾ�Ŀ����ǵ縺��
C.y���ʾ�Ŀ�����ԭ�Ӱ뾶D.y���ʾ�Ŀ������γɻ�̬����ת�Ƶĵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2 ��CH4�dz����Ļ����ͬʱҲ�dz��õĻ���ԭ�ϡ�
������CO2��NH3Ϊԭ�Ͽ��Ժϳ�����[CO(NH2)2]���ϳ����صķ�ӦΪ2NH3(g) + CO2(g) ![]() CO(NH2)2(s) + H2O(g)��
CO(NH2)2(s) + H2O(g)��
��1���ڲ�ͬ�¶ȼ���ͬyֵ�ºϳ����أ��ﵽƽ��ʱ������ת���ʱ仯�����ͼ��ʾ��
�ٸ÷�Ӧ����H_____0������>�� ����<�� �����÷�Ӧ�Է����е�������_______________ (���������������������������¶����� ��y��ʾ��Ӧ��ʼʱ�İ�̼��[![]() ]����y1________y2��������>������<������=������
]����y1________y2��������>������<������=������
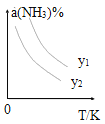
��2��t��ʱ�������ݻ��̶����ܱ������м���һ������ NH3��CO2�ϳ����أ�����������˵���˷�Ӧ�ﵽƽ��״̬����________ (����ĸ)��
a����������ƽ����Է����������ֲ���
b��CO2��NH3������������ֲ���
c��CO2��NH3��ת�������
d�����������ܶȱ��ֲ���
e��1molCO2���ɵ�ͬʱ�� 2molN��H������
II����ҵ����CH4��ˮ������һ����������ȡH2����CH4(g) + H2O(g) ![]() CO(g) + 3H2(g) ��H = + 203 kJmol��1
CO(g) + 3H2(g) ��H = + 203 kJmol��1
�ٸ÷�Ӧ�淴Ӧ���ʱ���ʽΪ��v��=kc(CO) c3(H2)��k Ϊ���ʳ�������ij�¶��²��ʵ�����������
COŨ��(molL��1) | H2Ũ��(molL��1) | �淴Ӧ����(molL��1min��1) |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.1 | 8.1 |
���������ݿɵø��¶��£��÷�Ӧ���淴Ӧ���ʳ���kΪ____L3mol��3min��1��
��ij�¶��£������Ϊ3 L���ܱ�������ͨ�����ʵ�����Ϊ3 mol��CH4��ˮ����������������Ӧ��5����ʱ�ﵽƽ�⣬��ʱH2���������Ϊ60%������5��������CH4Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(CH4)=________�����¶��¸÷�Ӧ��ƽ�ⳣ��K=________��ƽ������������м���1 mol CH4��1 mol CO��ƽ��_______�ƶ�����������Ӧ�����������淴Ӧ������������������
III���ڳ����£���0.02mol CO2ͨ��200mL 0.15mol/L��NaOH��Һ�У���ַ�Ӧ�����й�ϵʽ����ȷ����_____________________
A��c(Na+)>c(HCO3-)> c(CO32-)>c(OH-)>c(H+)
B��3c (Na+)=2[c(CO32-)+ c(HCO3-)+ c(H2CO3)]
C��c (Na+)+c(H+)=c(HCO3-)+ c(CO32-)+c(OH-)
D��c(HCO3-)+ 3c(H2CO3)+2c(H+)= c(CO32-)+2c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����·�Ӧ�ɻ��������Դ������(![]() )������˵������ȷ����
)������˵������ȷ����
��![]()
![]()
��![]()
![]()
��![]()
![]()
��![]()
![]()
A. ��Ӧ�١���Ϊ��Ӧ���ṩԭ����
B. ��Ӧ��Ҳ��![]() ��Դ�����õķ���֮һ
��Դ�����õķ���֮һ
C. ��Ӧ![]() ��
��![]()
D. ��Ӧ![]() ��
��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ�帻Ӫ����������ˮ����N��P��Ӫ���κ�������������ˮ����Ⱦ����ȥ��ˮ����N��P�ķ����ܶࡣ
(1)��ѧ������ȥ��ˮ���е�PO![]() �����õĻ�������AlCl3��Ca(OH)2�ȡ�
�����õĻ�������AlCl3��Ca(OH)2�ȡ�
��AlCl3��Һ��Al3+ˮ������ӷ���ʽΪ___��
��Ca5(PO4)3OH��KspΪ6.8��10-37�����ܶȻ���������ʽΪKsp[Ca5(PO4)3OH]=___��
(2)Ϊ̽������ˮ�а�̬��(NH3��N)��PO![]() ͬʱȥ������n(NH4Cl):n(Na2HPO4):n(MgCl2)=1:1:1����ˮ�У�ʵ���ò�ͬpH�£���̬����PO
ͬʱȥ������n(NH4Cl):n(Na2HPO4):n(MgCl2)=1:1:1����ˮ�У�ʵ���ò�ͬpH�£���̬����PO![]() ��ȥ������ͼ(a)��ʾ��
��ȥ������ͼ(a)��ʾ��

��֪��(I)ȥ������Ҫ��ӦΪ��Mg2++NH![]() +HPO
+HPO![]() +6H2O
+6H2O![]() MgNH4PO4��6H2O��+H+��
MgNH4PO4��6H2O��+H+��
(II)����ʱ��Ksp(MgNH4PO4��6H2O)=2.5��10-13��Ksp[Mg(OH)2]=1.8��10-11��Ksp[Mg3(PO4)2]= 6.3��10-31��
��pH��8.5��10.5ʱ����̬����PO![]() ȥ������pH�����������ԭ����___ (��ƽ���ƶ��Ƕ�˵��)��
ȥ������pH�����������ԭ����___ (��ƽ���ƶ��Ƕ�˵��)��
�ڵ�pH��10.5ʱ����̬����PO![]() ȥ������pH�������С����ԭ����___(��ƽ���ƶ��Ƕ�˵��)��
ȥ������pH�������С����ԭ����___(��ƽ���ƶ��Ƕ�˵��)��
(3)һ�ֽ�ûʽSMDDC��ؿ�����ȥ������ˮ����̬������װ����ͼ(b)��ʾ��

��װ�ù���ʱ��H+��___��(�X����Y")��Ǩ�ơ�
��X����(CH2O)n��CO2�ĵ缫��ӦʽΪ___��Y����NO![]() ��N2�ĵ缫��ӦʽΪ___��
��N2�ĵ缫��ӦʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016��8��,���Ϲ������ƻ������й��������⾭��ʾ���������ڽ����仧����������H2��̼���ܵȲ��������Ķ��ε�ص�ԭ������ͼ��ʾ������˵����ȷ���ǣ� ��

A.�ŵ�ʱ���缫Ϊ������OH-�����ҵ缫
B.�ŵ�ʱ���ҵ缫��ӦΪNi(OH)2+OH--e-=NiO(OH)+H2O
C.���ʱ����صļ缫��ֱ����Դ����������
D.����ܷ�ӦΪH2+2NiOOH![]() 2Ni(OH)2
2Ni(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ױ�������Ҫ���л�����ԭ�ϣ������������л����ͨ�������������ӡ����������ȱ�������ϩ�ȡ�
��1�����и��������У�����������KMnO4��Һ�������______������ĸ����
a ���ͼױ� b ���ͼ��� c ��ϩ�ͱ� d ��ϩ����Ȳ
��2���ڱ���ȩ�������ܹ�ƽ���ԭ�������______����һ�������£�1 mol����ȩ������������Cu��OH��2��ַ�Ӧ������Cu2O�����ʵ���Ϊ______mol��
��3���Ա�Ϊ��Ҫԭ����ȡ����ϩ�ĺϳ�·������ͼ�ɱ�ʾ���£�

��B�к��������ŵ�������______��
��A��B��C��D�к�������̼ԭ�ӵ���______������ĸ����
��д��C����ᷴӦ������Ӧ���Ļ�ѧ����ʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��º��ݵ��ܱ������У��п��淴Ӧ��![]() �����в���˵����Ӧ�Ѵﵽƽ��״̬���ǣ� ��
�����в���˵����Ӧ�Ѵﵽƽ��״̬���ǣ� ��
A.![]()
B.��Ӧ���е�ѹǿ����ʱ��ı仯���仯
C.����������ɫ���ֲ���
D.��������ƽ����Է����������ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��xA��g��+yB��g��![]() zC��g������H=a����xmolA��ymolB������ܱ������У��ڲ�ͬ�¶ȣ�T1>T2����ѹǿ��P1>P2���£�C�����ʵ���n��C���뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ�������ж���ȷ���ǣ� ��
zC��g������H=a����xmolA��ymolB������ܱ������У��ڲ�ͬ�¶ȣ�T1>T2����ѹǿ��P1>P2���£�C�����ʵ���n��C���뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ�������ж���ȷ���ǣ� ��

A.x+y=z��a>0B.x+y>z��a<0
C.x+y<z��a<0D.x+y<z��a>0
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com