
【题目】已知H+(aq) + OH-(aq) = H2O(1);ΔH = - 57. 3 kJ·mol-1,其中aq代表稀溶液,以下四个反应方程式中,反应热ΔH = - 57.3 kJ·mol-1的是( )
A. H2SO4(aq) +2NaOH(aq) = Na2SO4(aq)+ 2H2O(1)
B. ![]() H2SO4(aq) +
H2SO4(aq) +![]() Ba(OH)2(aq) =
Ba(OH)2(aq) = ![]() BaSO4(s)+ H2O(1)
BaSO4(s)+ H2O(1)
C. HCl(aq) +NaOH(aq) = NaCl(aq)+ H2O(1)
D. HCl(aq) + NH3 ·H2O (aq) = NH4Cl (aq) + H2O(1)
【答案】C
【解析】A. H2SO4(aq) +2NaOH(aq) = Na2SO4(aq)+ 2H2O(1),生成2 mol水,ΔH = - 114.6kJ·mol-1,故A错误;![]() H2SO4(aq) +
H2SO4(aq) +![]() Ba(OH)2(aq) =
Ba(OH)2(aq) = ![]() BaSO4(s)+ H2O(1),有硫酸钡沉淀生成,所以放出热量大于57.3KJ,故B错误;C. HCl(aq) +NaOH(aq) = NaCl(aq)+ H2O(1),生成1 mol水,所以△H=-57.3KJ/mol,故C正确;HCl(aq) + NH3 ·H2O (aq) = NH4Cl (aq) + H2O(1),氨水是弱碱,放热小于57.3KJ,故D错误;
BaSO4(s)+ H2O(1),有硫酸钡沉淀生成,所以放出热量大于57.3KJ,故B错误;C. HCl(aq) +NaOH(aq) = NaCl(aq)+ H2O(1),生成1 mol水,所以△H=-57.3KJ/mol,故C正确;HCl(aq) + NH3 ·H2O (aq) = NH4Cl (aq) + H2O(1),氨水是弱碱,放热小于57.3KJ,故D错误;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】乙醚(CH3CH2OCH2CH3)曾经用作麻醉剂,实验室中可将乙醇、浓硫酸的混合液加热至 140℃制取一定量的乙醚,制备原理、装置、有关物质的部分性质如下(夹持装置、加热仪器和沸石均略去):
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O

沸点/℃ | 水溶性 | 密度(g/mL) | |
乙醇 | 78 | 混溶 | 0.8 |
乙醚 | 34.6 | 难溶 | 0.7 |
回答下列问题:
(1)温度计 X 的水银球应位于_____________________。
(2)使用仪器 B 与不使用仪器 B 相比,其优点是_____________________。
(3)所得到的乙醚中含有一定量的乙醇及酸性物质。为得到高纯度的乙醚,可依次用NaOH 溶液、水洗涤;然后用无水 CaCl2干燥,最后进行蒸馏精制。
① 洗涤操作应在_____________(填仪器名称)中进行。
② 蒸馏精制时,最好的加热方式是________________________。
③ 若实验中使用了57.5mL 无水乙醇, 最后得到乙醚 18.0mL,则乙醚的产率为_____。
(4)实验中,发现 A 中的液体会变黑; E 中的溶液会逐渐褪色,加热后又会变红。
① A 中溶液颜色变黑的原因是________________________
②乙醇、浓硫酸的混合液在加热条件下会有副反应发生,生成两种常见的无机气体,该副反应的化学方程式为______________________。
(5)要证明该反应中有 CO2生成,在 F 后面连接一个盛有澄清石灰水的洗气瓶,并将F中的液体改为______溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下由三种短周期元素形成的气体单质X、Y、Z,并有下列转化关系(反应条件已略去):已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子。

(1)写出单质X的结构式是________________________________________________;
(2)化合物甲的电子式是_____________________________;其水溶液呈________ 性。
(3)化合物丙中存在的化学键是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,![]() 与R-发生如下反应
与R-发生如下反应![]() +5R-+6H+=3R2+3H2O,下列有关R元素的叙述正确的是( )
+5R-+6H+=3R2+3H2O,下列有关R元素的叙述正确的是( )
A. R是第ⅤA族元素 B. R2在常温下一定是气体
C. ![]() 中的R元素只能被还原 D. R的氢化物的水溶液是强酸
中的R元素只能被还原 D. R的氢化物的水溶液是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向 10mL 0.1mol/ LCuCl2 溶液中滴加 0.1mol/L 的 Na2S 溶液,滴加过程中,溶液中-lgc(Cu2+)与 Na2S 溶液体积(V)的关系如右下图所示,已知:lg2=0.3,Ksp(ZnS)=3×10-25mo/L2。下列有关说法不正确的是
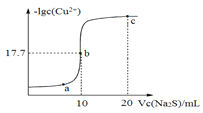
A. a、b、c 三点中,水的电离程度最大的为 b 点
B. Na2S 溶液中:2[c(S2-)+c(HS-)+c(H2S)]=c(Na+)
C. 该温度下 Ksp(CuS)=4×10-36mol2/L2
D. 向 100mLZn2+、Cu2+浓度均为10-5mol/L 的混合溶液中逐滴加入10-4mol/L 的 Na2S溶液,Cu2+先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化如图,关于该反应的下列说法中,正确的是( )
CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化如图,关于该反应的下列说法中,正确的是( )

A. ΔH>0,ΔS>0 B. ΔH>0,ΔS<0
C. ΔH<0,ΔS<0 D. ΔH<0,ΔS>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生物体内化学元素的叙述错误的是
A. 同一生物体不同组织细胞内化学元素种类和含量大体相同
B. C、H、O、N是组成生物体的基本元素
C. 蛋白质中的S元素存在于氨基酸的R基中
D. Fe虽然是微量元素,但是参与血红蛋白的合成,对生命活动很重要
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题。
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
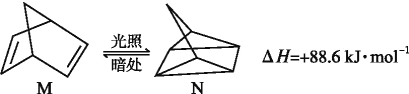
则M、N相比, 较稳定的是____。
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)![]() 2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为________
2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为________
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_________________
(4)根据下列热化学方程式:
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1;
②H2(g)+1/2O2(g)===H2O(l) ΔH2=-285.8 kJ·mol-1;
③CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH3=-870.3 kJ·mol-1
可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com