
����Ŀ��̼���γɻ�������������Ԫ��,�䵥�ʼ������������������������Ҫ��Դ���ʡ���ش��������⡣
��1���л���M����̫������տ�ת����N,ת����������:
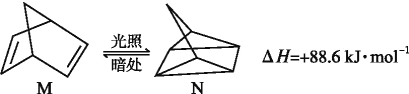
��M��N���, ���ȶ�����____��
��2������͵�������ı������������ʡ���ʯī�����ۺͶ������Ѱ�һ����������ڸ���������,�������ʿ������²���,4Al(s)+3TiO2(s)+3C(s)![]() 2Al2O3(s)+3TiC(s)����H=-1 176 kJ��mol-1,��Ӧ������,ÿת��1 mol���ӷų�������Ϊ________
2Al2O3(s)+3TiC(s)����H=-1 176 kJ��mol-1,��Ӧ������,ÿת��1 mol���ӷų�������Ϊ________
��3����֪��1 mol H��H����1 mol N��H����1 mol N��N���ֱ���Ҫ��������436 kJ��391 kJ��946 kJ,��N2��H2��Ӧ����NH3���Ȼ�ѧ����ʽΪ_________________
��4�����������Ȼ�ѧ����ʽ��
��C(s)��O2(g)===CO2(g)����H1����393.5 kJ��mol��1��
��H2(g)��1/2O2(g)===H2O(l)����H2����285.8 kJ��mol��1��
��CH3COOH(l)��2O2(g)===2CO2(g)��2H2O(l) ��H3����870.3 kJ��mol��1
���Լ����2C(s)��2H2(g)��O2(g)===CH3COOH(l)�ķ�Ӧ��Ϊ________
���𰸡� M 98kJ N2(g)+3H2(g) ![]() 2NH3(g) ��H����92 kJ��mol��1 ��488.3 kJ��mol��1
2NH3(g) ��H����92 kJ��mol��1 ��488.3 kJ��mol��1
������������:(1) Mת����NΪ���ȷ�Ӧ����1molM���е�����������1molN���е���������M���ȶ���
(2)������Ӧ��ת��12������,��ÿת��1mol���ӷų�������Ϊ![]() =98 kJ��
=98 kJ��
��3���ڷ�ӦN2+3H2![]() 2NH3�У�����3molH-H����1mol N�� N�������յ�����Ϊ��3��436kJ+946kJ=2254kJ������2mol NH3�����γ�6mol N-H�����ų�������Ϊ��6��391kJ=2346kJ�����յ������٣��ų��������࣬�÷�ӦΪ���ȷ�Ӧ���ų�������Ϊ��2346kJ-2254kJ=92kJ��
2NH3�У�����3molH-H����1mol N�� N�������յ�����Ϊ��3��436kJ+946kJ=2254kJ������2mol NH3�����γ�6mol N-H�����ų�������Ϊ��6��391kJ=2346kJ�����յ������٣��ų��������࣬�÷�ӦΪ���ȷ�Ӧ���ų�������Ϊ��2346kJ-2254kJ=92kJ��
��4�������Ȼ�ѧ����ʽ��˹���ɽ��з�������,ͨ���Ȼ�ѧ����ʽ����2������2����ټ�ȥ����ȥ������̼��ˮ�õ�������Ȼ�ѧ����ʽ��ע���Ȼ�ѧ����ʽ�ı�ϵ�����ʱ���֮�ı���
���:(1)�л���M����̫������տ�ת����N,
��H��+88.6 kJ��mol��1�����������ȷ�Ӧ��N����ת��ΪM���Ƿ��ȷ�Ӧ������Խ��Խ�ȶ�,˵��M�ȶ���
��ˣ�������ȷ����:M��
(2) 4Al(s)+3TiO2(s)+3C(s)![]() 2Al2O3(s)+3TiC(s)�� ��H=-1 176 kJ��mol-1,ת��12mol���ӷ���1 176 kJ,��Ӧ������,ÿת��1mol���ӷ���98 kJ��
2Al2O3(s)+3TiC(s)�� ��H=-1 176 kJ��mol-1,ת��12mol���ӷ���1 176 kJ,��Ӧ������,ÿת��1mol���ӷ���98 kJ��
��ˣ�������ȷ����: 98 kJ��
(3)�ڷ�ӦN2+3H2![]() 2NH3�У�����3molH-H����1mol N�� N�������յ�����Ϊ��3��436kJ+946kJ=2254kJ������2mol NH3�����γ�6mol N-H�����ų�������Ϊ��6��391kJ=2346kJ�����յ������٣��ų��������࣬�÷�ӦΪ���ȷ�Ӧ���ų�������Ϊ��2346kJ-2254kJ=92kJ����N2(g)+3H2(g)=2NH3(g) ��H=-92kJ��mol-1���ʴ�Ϊ��N2(g)+3H2(g)=2NH3(g) ��H=-92kJ��mol-1
2NH3�У�����3molH-H����1mol N�� N�������յ�����Ϊ��3��436kJ+946kJ=2254kJ������2mol NH3�����γ�6mol N-H�����ų�������Ϊ��6��391kJ=2346kJ�����յ������٣��ų��������࣬�÷�ӦΪ���ȷ�Ӧ���ų�������Ϊ��2346kJ-2254kJ=92kJ����N2(g)+3H2(g)=2NH3(g) ��H=-92kJ��mol-1���ʴ�Ϊ��N2(g)+3H2(g)=2NH3(g) ��H=-92kJ��mol-1
��4����C(s)��O2(g)===CO2(g)����H1����393.5 kJ��mol��1��
��H2(g)��1/2O2(g)===H2O(l)����H2����285.8 kJ��mol��1��
��CH3COOH(l)��2O2(g)===2CO2(g)��2H2O(l) ��H3����870.3 kJ��mol��1
���ݸ�˹�������Ȼ�ѧ����ʽ����2+����2-���õ�: ��H����488.3 kJ��mol��1��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H+(aq) + OH-(aq) = H2O(1)����H = - 57. 3 kJ��mol-1������aq����ϡ��Һ�������ĸ���Ӧ����ʽ�У���Ӧ�Ȧ�H = - 57.3 kJ��mol-1���ǣ� ��
A. H2SO4(aq) +2NaOH(aq) = Na2SO4(aq)+ 2H2O(1)
B. ![]() H2SO4(aq) +
H2SO4(aq) +![]() Ba(OH)2(aq) =
Ba(OH)2(aq) = ![]() BaSO4(s)+ H2O(1)
BaSO4(s)+ H2O(1)
C. HCl(aq) +NaOH(aq) = NaCl(aq)+ H2O(1)
D. HCl(aq) + NH3 ��H2O (aq) = NH4Cl (aq) + H2O(1)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���������� n ��CH 2 �� m �� ![]() ��a��CH 3 �� ����ΪOH��������ʷ�����OH�ĸ�������Ϊ��������
��a��CH 3 �� ����ΪOH��������ʷ�����OH�ĸ�������Ϊ��������
A.m��a
B.n+m+a
C.m+1��a
D.m+2��a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯ��ʯ��ʳ�Ρ���̿��ˮΪԭ�ϣ�д���ϳɾ�����ϩ�Ļ�ѧ����ʽ������֪��CaO+3C ![]() CaC2+CO����
CaC2+CO����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɻ�ѧ��ת������ܻ������Ȼ������ʹ�õ���Ҫ��Դ��������ͼ��ʾ��װ�ã��ж�����˵������ȷ���ǣ������� 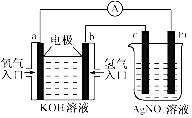
A.��װ����Pt��Ϊ����
B.��c���������仯��2.16gʱ��a�������ĵ�O2�ڱ�״���µ����Ϊ1.12L
C.��װ����b���ĵ缫��Ӧʽ�ǣ�H2+2OH����2e��=2H2O
D.��װ����a��Ϊ����������������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2005��2��18�գ�Ӣ��ʳƷ������Ӣ�����ڷ������棬������359��ʳƷ�к��п����°��ġ��յ���һ�š���һʱ�䡰�յ���һ�š���Ϊý���ע�Ľ��㡣���յ���һ�š��Ľṹ��ʽ��ͼ�����й����յ���һ�ŵ��й�������ȷ����
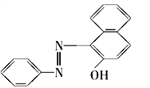
A. �յ���һ�ŵķ���ʽC18H12N2O
B. �յ���һ�ŵ���Է���������248 g��mol��1
C. �յ���һ��������
D. �յ���һ���ܷ����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ�������
A.��ϡ��ˮ��μ���ϡ�����У�����Һ��pH=7ʱ��c��SO42������c��NH4+��
B.NaHCO3��Һ�У�c ��CO32����+c��H+��=c��H2CO3��+c��OH����
C.1 L 0��1 molL��1CuSO4��NH4��2SO46H2O��Һ�У�c��SO42������c��NH4+����c��Cu2+����c��H+����c��OH����
D.��0.1mol/L�İ�ˮ�м�����������粒��壬����Һ��c��OH����/c��NH3H2O������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���Aֻ����C��H��O����Ԫ�أ��������л��ϳɵ��м��塣16.8g���л��ᆳȼ������44.0g CO2 ��14.4g H2O������ͼ��������Է�������Ϊ84���������������A�����к���O-H����-C��C-H�����Ź����������������壬�����֮��Ϊ6:1:1��
��1��A�ķ���ʽ��______________��
��2��A�Ľṹ��ʽ��___________________��
��3��A��һ�������£��ܷ����ķ�Ӧ����Ϊ____________________��
a.�ӳɷ�Ӧ b.������Ӧ c.�ۺϷ�Ӧ d.ȡ����Ӧ
��4���л���B��A��ͬ���칹�壬1molB����1molBr2��ȫ�ӳɡ���֪��B�ṹ�к���ȩ����B������̼ԭ��һ������ͬһ��ƽ�棬��д�����з���������B�Ľṹ��ʽ�������������칹��_________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com