
【题目】用石灰石、食盐、焦炭、水为原料,写出合成聚氯乙烯的化学方程式.(已知:CaO+3C ![]() CaC2+CO↑)
CaC2+CO↑)
【答案】①CaCO3![]() CaO+CO2↑、②CaO+3C
CaO+CO2↑、②CaO+3C ![]() CaC2+CO↑、③CaC2+2H2O→Ca(OH)2+CH≡CH↑、④2NaCl+H2O
CaC2+CO↑、③CaC2+2H2O→Ca(OH)2+CH≡CH↑、④2NaCl+H2O ![]() 2NaOH+H2↑+Cl2↑、⑤H2+Cl2
2NaOH+H2↑+Cl2↑、⑤H2+Cl2![]() 2HCl、
2HCl、 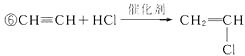 、
、 
【解析】解:石灰石主要成分为碳酸钙,在高温条件下生成氧化钙和二氧化碳,反应为:①CaCO3 ![]() CaO+CO2↑,氧化钙与碳高温反应生成碳化钙(电石),反应为:②CaO+3C
CaO+CO2↑,氧化钙与碳高温反应生成碳化钙(电石),反应为:②CaO+3C ![]() CaC2+CO↑,电石和水反应生成HC≡CH,反应为:③CaC2+2H2O→Ca(OH)2+CH≡CH↑,食盐水电解生成氢气和氯气,反应为:④2NaCl+H2O
CaC2+CO↑,电石和水反应生成HC≡CH,反应为:③CaC2+2H2O→Ca(OH)2+CH≡CH↑,食盐水电解生成氢气和氯气,反应为:④2NaCl+H2O ![]() 2NaOH+H2↑+Cl2↑,氢气和氯气反应生成氯化氢,反应为:⑤H2+Cl2
2NaOH+H2↑+Cl2↑,氢气和氯气反应生成氯化氢,反应为:⑤H2+Cl2 ![]() 2HCl,HC≡CH与HCl发生加成反应生成氯乙烯,反应为:
2HCl,HC≡CH与HCl发生加成反应生成氯乙烯,反应为: 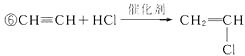 ,氯乙烯(CH2=CHCl)发生加聚反应得到高聚物聚氯乙烯,反应为:
,氯乙烯(CH2=CHCl)发生加聚反应得到高聚物聚氯乙烯,反应为:  ,
,
所以答案是:①CaCO3 ![]() CaO+CO2↑、②CaO+3C
CaO+CO2↑、②CaO+3C ![]() CaC2+CO↑、③CaC2+2H2O→Ca(OH)2+CH≡CH↑、④2NaCl+H2O
CaC2+CO↑、③CaC2+2H2O→Ca(OH)2+CH≡CH↑、④2NaCl+H2O ![]() 2NaOH+H2↑+Cl2↑、⑤H2+Cl2
2NaOH+H2↑+Cl2↑、⑤H2+Cl2 ![]() 2HCl、
2HCl、 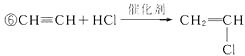 、
、  .
.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,![]() 与R-发生如下反应
与R-发生如下反应![]() +5R-+6H+=3R2+3H2O,下列有关R元素的叙述正确的是( )
+5R-+6H+=3R2+3H2O,下列有关R元素的叙述正确的是( )
A. R是第ⅤA族元素 B. R2在常温下一定是气体
C. ![]() 中的R元素只能被还原 D. R的氢化物的水溶液是强酸
中的R元素只能被还原 D. R的氢化物的水溶液是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生物体内化学元素的叙述错误的是
A. 同一生物体不同组织细胞内化学元素种类和含量大体相同
B. C、H、O、N是组成生物体的基本元素
C. 蛋白质中的S元素存在于氨基酸的R基中
D. Fe虽然是微量元素,但是参与血红蛋白的合成,对生命活动很重要
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C8H18经多步裂化,最后完全转化为C4H8、C3H6、C2H4、C2H6、CH4五种气体的混合物.该混合物的平均相对分子质量可能是( )
A.28
B.30
C.38
D.40
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素在生物体内虽然很少,却是维持生命活动不可缺少的,下面哪一实例证明了
A. Mg是叶绿素的组成成分
B. 油菜缺少B时只开花不结果
C. 动物血液Ca盐含量太低,会抽搐
D. 缺P会影响核酸的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表的说法不正确的是( )
A.第15列某元素能与其他元素化合形成碱性气体
B.第2列元素中肯定没有非金属元素
C.第17列的第一种元素的原子序数为9
D.短周期中能与强碱反应产生H2的金属元素位于第ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题。
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
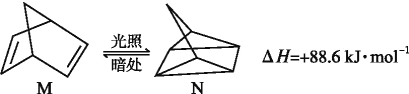
则M、N相比, 较稳定的是____。
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)![]() 2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为________
2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为________
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_________________
(4)根据下列热化学方程式:
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1;
②H2(g)+1/2O2(g)===H2O(l) ΔH2=-285.8 kJ·mol-1;
③CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH3=-870.3 kJ·mol-1
可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中,溶液的pH大于7的是
A. 向NaCl溶液中滴加醋酸 B. 向KNO3溶液中滴加稀H2SO4
C. 向稀HCl溶液中滴加稀HNO3 D. 向NaOH溶液中滴加Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用镁一次氯酸钠燃料电池作电源模拟消除工业酸性废水中的Cr2O72-的过程(将“Cr2O72-”还原为“Cr3+”),装置如图所示。下列说法中错误的是
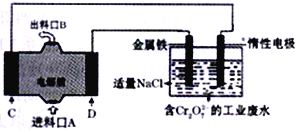
A. 金属铁电极的反应为:Fe-2e-=Fe2+
B. 装置中电子的流动路线是: C电极→惰性电极→金属铁电极→D电极
C. 装置工作过程中消耗14.4gMg,理论上可消除Cr2O72-0.1mol
D. 将Cr2O72-处理后的废水比原工业废水的pH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com