
����Ŀ���ɽ���߷��Ӳ���P�ĽṹΪ��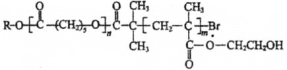 ����ͼ��P�ĺϳ�·�ߡ�
����ͼ��P�ĺϳ�·�ߡ�
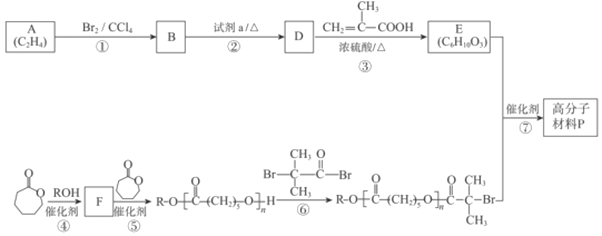
��֪��![]() +R3OH
+R3OH![]() +R2OH��
+R2OH��
��1��B�Ľṹ��ʽ��_______���Լ�a��_______��
��2���۵Ļ�ѧ����ʽ��______��
��3��G��E��Ϊͬ���칹�壬��������Ҫ���G����______�֡�(�����������칹)�ٺ��к�E(C6H10O3)��ͬ�ĺ��������Ţڷ����к�����Ԫ��״�����ṹ
��4�������з�Ӧ�������ʵ���֮��1��1������Ӧʱ����Ӧ�ݵĻ�ѧ����ʽ��_____��
���𰸡�BrCH2CH2Br NaOHˮ��Һ ![]() 20
20 ![]()
��������
C2H4Ϊ��ϩ���ṹΪCH2=CH2����Br2�����ӳɷ�Ӧ������B��BrCH2CH2Br����������������ˮ��Һ�ɷ���ˮ�ⷴӦ����D�Ҷ�����HOCH2CH2OH����D��![]() ����������Ӧ������E��
����������Ӧ������E��![]() ����
����![]() ��ROH��Ӧ����F��F�ĽṹΪ
��ROH��Ӧ����F��F�ĽṹΪ![]() ��F�������۷�Ӧ����
��F�������۷�Ӧ����![]() ��
��![]() ��
��![]() ��Ӧ����
��Ӧ����![]() ��
��![]() ��
��![]() ��Ӧ���ɸ߷��Ӳ���P���Դ�����
��Ӧ���ɸ߷��Ӳ���P���Դ�����
�ɷ�����֪AΪCH2=CH2��BΪBrCH2CH2Br��DΪHOCH2CH2OH��EΪ![]() ��FΪ
��FΪ![]() ��
��
��1��BΪBrCH2CH2Br��D���Լ�a�����ķ�ӦΪˮ�ⷴӦ������Լ�aΪ�������Ƶ�ˮ��Һ��
��2����Ӧ��ΪHOCH2CH2OH��![]() ������������Ӧ������ʽΪ��
������������Ӧ������ʽΪ��![]() ��
��
��3��EΪ![]() ��G��E��Ϊͬ���칹�壬�Ңٺ��к�E(C6H10O3)��ͬ�ĺ��������ţ�˵��G�к����������ǻ����ڷ����к�����Ԫ��״�����ṹ��˵�������ڻ��ڣ�����
��G��E��Ϊͬ���칹�壬�Ңٺ��к�E(C6H10O3)��ͬ�ĺ��������ţ�˵��G�к����������ǻ����ڷ����к�����Ԫ��״�����ṹ��˵�������ڻ��ڣ����� �ṹ���ɴ˿�֪�ṹ����1��-CH2OH��1��-CH3��1��-OH������Ԫ����������1��-CH2OH����4�ֲ�ͬ�Ľṹ������Ԫ����������1��-CH3��1��-OH������-CH3��-OH�ֱ�������2����ͬ��̼ԭ���ϵĽṹ��12�֣�������ͬһ��̼ԭ���ϵĽṹ��4�֣���˷���������/span>G��4+12+4=20�֣�
�ṹ���ɴ˿�֪�ṹ����1��-CH2OH��1��-CH3��1��-OH������Ԫ����������1��-CH2OH����4�ֲ�ͬ�Ľṹ������Ԫ����������1��-CH3��1��-OH������-CH3��-OH�ֱ�������2����ͬ��̼ԭ���ϵĽṹ��12�֣�������ͬһ��̼ԭ���ϵĽṹ��4�֣���˷���������/span>G��4+12+4=20�֣�
��4�������з�Ӧ�������ʵ���֮��1��1������Ӧʱ����Ӧ�ݵĻ�ѧ����ʽΪ��![]() ��
��


 ����ѧ��Ӯ�����ϵ�д�
����ѧ��Ӯ�����ϵ�д� ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��̼�Ļ������������������е�Ӧ�÷dz��㷺�����ᳫ���������ѳɳ����Ľ��죬����̼����������ֻ��һ�����룬����һ��ֵ���ڴ����µ����ʽ��
(1) ����ȼ�շų��������ȣ�����Ϊ��Դ������������������
��֪����2CH4��g��+3O2��g��=2CO��g��+4H2O��l����H1=-1214kJ/mol
��2CO(g)+O2(g)=2CO2(g) ��H2=-566 kJ/mol
���ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ____________________________________��
(2) ������ʯī�缫����KOH��Һ�У��������ֱ�ͨ��CH4��O2�����ɼ���ȼ�ϵ�ء��为���缫��Ӧʽ�ǣ�_____________________________��
��3��ijͬѧ���ü���ȼ�ϵ�������һ�ֵ�ⷨ��ȡFe(OH)2��ʵ��װ�ã�����ͼ��ʾ����ͨ�����Һ�в��������İ�ɫ�������ҽϳ�ʱ�䲻��ɫ������˵������ȷ����______������ţ�
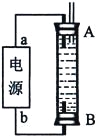
A����Դ�е�aһ��Ϊ������bһ��Ϊ����
B��������NaCl��Һ��Ϊ���Һ
C��A��B���˶������������缫
D�����������ķ�Ӧ�ǣ�2H++ 2e��= H2��
��4������ͬ����CO��g����H2O��g���ֱ�ͨ�����Ϊ2L�ĺ����ܱ������У����з�Ӧ��
CO��g��+H2O��g��===CO2��g��+H2��g�����õ������������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | |
H2O | CO | CO2 | |||
1 | 650 | 2 | 4 | 1.6 | 5 |
2 | 900 | 1 | 2 | 0.4 | 3 |
3 | 900 | 1 | 2 | 0.4 | 1 |
��ʵ��
��ʵ��3��ʵ��2��ȣ��ı������������_________________����һ��������ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��Һ�п��ܺ���![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() �⼸�������е������֣����ν�������ʵ�飬�۲쵽�������¼���£���
�⼸�������е������֣����ν�������ʵ�飬�۲쵽�������¼���£���![]() ��ֽ���飬��Һ��
��ֽ���飬��Һ��![]() ��ȡ����ԭ��Һ������Һ�м��������
��ȡ����ԭ��Һ������Һ�м��������![]() ������Ļ����Һ���ް�ɫ�������ɢ���ȡ����ԭ��Һ������Һ�еμ�������ˮ��������������ټ���
������Ļ����Һ���ް�ɫ�������ɢ���ȡ����ԭ��Һ������Һ�еμ�������ˮ��������������ټ���![]() �����ú�
�����ú�![]() ��ʳ�ɫ���÷�Һ©����Һ�����Һ���ˮ��Һ�м���
��ʳ�ɫ���÷�Һ©����Һ�����Һ���ˮ��Һ�м���![]() ��
��![]() ��Һ���а�ɫ��������������Һ�м���
��Һ���а�ɫ��������������Һ�м���![]() ��
��![]() �Ļ����Һ�а�ɫ���������������ԭ��Һ���ж�����ȷ����
�Ļ����Һ�а�ɫ���������������ԭ��Һ���ж�����ȷ����
A.�϶������ڵ�������![]() ��
��![]() ��
��![]() ��
��![]()
B.�϶����ڵ�������![]() ��
��![]() ��
��![]()
C.��ȷ��ԭ��Һ���Ƿ����![]() ��
��![]()
D.������ܸ���![]() ������Ļ����Һ�������Һ�����ӵ��ж�Ҳ��Ӱ��
������Ļ����Һ�������Һ�����ӵ��ж�Ҳ��Ӱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һˮ�����İ���ͭ����[Cu(NH3)4SO4��H2O]������ɱ�����ýȾ�����ڼ��Զ�ͭ��Ҳ���������Һ����Ҫ�ɷ֣��ڹ�ҵ����;�㷺�������¸����ʿ�����ˮ���������Ҵ����ڿ����в��ȶ�������ʱ�����ֽ⡣ij��ѧ��ȤС����Cu�ۡ�3mol��L-1�����ᡢŨ��ˮ��10% NaOH��Һ��95%���Ҵ���Һ��0.500 mol��L-1ϡ���ᡢ0.500 mol��L-1 ��NaOH��Һ���Ʊ�һˮ�����İ���ͭ���岢�ⶨ�䴿�ȡ�
I��CuSO4��Һ����ȡ
��ʵ������ͭ��Ũ�����Ʊ�����ͭ��Һʱ���������������Ⱦ��SO2���壬��������Ũ�ȱ�С����Ӧ��ֹͣ��ʹ�����������ʱȽϵ͡�
��ʵ��������������ͭƬ�ڿ����м��ȣ�ʹ����������CuO�����ܽ���ϡ�����м��ɵõ�����ͭ��Һ����һ����ȱ����ͭƬ��������ױ��������������������ͭ�ò���������
�����Թ�ҵ�Ͻ����˸Ľ��������ڽ��������е�ͭƬ���治��ͨ O2�������ȣ�Ҳ�����������ͭ�Ļ�������еμ� H2O2 ��Һ��
�ܳ��ȹ��˵���ɫ��Һ��
(1)ijͬѧ������ʵ���Ʊ�����ͭ��Һʱͭ��ʣ�࣬��ͬѧ���Ƶõ�CuSO4��Һ������һ�������м���Ũ�����о�Ĥ���֣���ȴ�����ľ����к��а�ɫ��ĩ���Խ�����ԭ��________________��
(2)�����۽����Ʊ�����д��Cu��H2O2 �����º�ϡ���ᷴӦ�Ļ�ѧ����ʽ_______________��
(3)H2O2��Һ��Ũ�ȶ�ͭƬ���ܽ�������Ӱ�졣��ͨ����ͼ������30����H2O2��ҺŨ����40������B��Ӧ����һ���豸�����豸��������____________������� ______________________��


II��������Ʊ�
�������Ʊ���CuSO4��Һ����ͼ��ʾ���в���
(1)����ͭ��Һ����һ�������ᣬ�����ԣ���������NH3��H2O������ҺpH������dz��ɫ��������֪��ɷ�Ϊ Cu2(OH)2SO4����д�����ɴ˳��������ӷ�Ӧ����ʽ__________��
(2)�����μ� NH3��H2O����ת����������ɫ��Һ����д��������ɫ��Һ����������ɫ����ķ���____________����˵������____________��
��.��Ʒ���ȵIJⶨ
��ȷ��ȡ mg ���壬������ˮ�ܽ⣬ע��ͼʾ������ƿ�У�Ȼ����μ������� NaOH ��Һ�� ͨ��ˮ����������ƷҺ�еİ�ȫ����������������ˮ��ϴ�����ڱڣ��� V1mL 0.500mol��L��1 ���������Һ��ȫ���ա�ȡ�½���ƿ���� 0.500 mol��L��1 NaOH ����Һ�ζ���ʣ�� HCl(ѡ�� ������ָʾ��)�����յ�ʱ���� V2mLNaOH ��Һ��

1.ˮ 2.�������� 3.10%NaOH��Һ 4.��ƷҺ 5.�������Һ
(1)������2������________________��
(2)��Ʒ�в�Ʒ���ȵı���ʽ________________�������û���
(3)����ʵ���������ʹ�������ⶨ���ƫ�͵�ԭ����_________________
A.�ζ�ʱδ�� NaOH ����Һ��ϴ�ζ���
B.�ζ�������ѡ�÷�̪��ָʾ��
C.����ʱ���ζ�ǰƽ�ӣ��ζ�����
D.ȡ�½���ƿǰ��δ������ˮ��ϴ�������ƿ�еĵ������
E.���ڲ������淶���ζ�ǰ�����ݣ��ζ���ζ����в�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���ͭ��һ����Ҫ�Ļ�����Ʒ���������л��ϳɴ����������������ϡ������ȹ�ҵ����������H2SO4��HNO3�ʹ�������ˮ��������Ũ����Ͱ�ˮ���ڳ�ʪ��������ˮ����������ɫ�ļ�ʽ�Ȼ�ͭ[Cu2��OH��4-nCln]�����Ż�����ȵĸı�n��֮�ı䡣�Ժ���ͭ����Ҫ�ɷ���Cu������CuO��Ϊԭ�ϣ���������������ֽ⼼������CuCl�Ĺ��չ������£�

��1�������õ��IJ����������ձ�����������________��
��2����ԭ�����з�������Ҫ��Ӧ�����ӷ���ʽ��__________������(NH4)2SO3��������Ҳ�ɵõ�CuCl��д�����ӷ���ʽ___________��
��3��������CuCl����ˮϴ��Ҫ��������ˮ�Ҵ�ϴ�ӣ�����ո��������70�����2h����ȴ�ܷ��װ����ո���ܷ��װ��ԭ���ǣ�______________________________��
��4������PHֵ��С[Cu2��OH��4-nCln]��Cu% ________��(����ĸ)
A. ���� B.���� C. ����ȷ�� D. ��С
��5����ͼ�Ǹ���Ӧ���������������£���Ӧ�¶ȶ�CuCl����Ӱ�졣��ͼ��֪����Һ�¶ȿ�����60��ʱ��CuCl�����ܴﵽ94%�����¶ȸ���65�� ʱ��CuCl���ʻ��½�����������ĽǶȷ�������ԭ�������_____��

��6����̼��Ϊ�缫���CuCl2��ҺҲ�ɵõ�CuCl��д�����ʱ�����Ϸ����ĵ缫��Ӧʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ʽ��NaHY��ˮ��Һ�Լ��ԣ�����������ȷ���ǣ� ��
A.H2Y�ĵ��뷽��ʽΪ��H2Y![]() 2H����Y2��
2H����Y2��
B.HY����ˮ�ⷽ��ʽΪ��HY����H2O![]() H3O����Y2��
H3O����Y2��
C.����ʽ����Һ������Ũ�ȹ�ϵΪ��c(Na��)��c(HY��)��c(OH��)��c(H��)��c(Y2��)
D.����ʽ����Һ������Ũ�ȹ�ϵΪ��c(Na��)��c(Y2��)��c(HY��)��c(OH��)��c(H��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C��N��S�������ﳣ�����һЩ�������⣬���й����������о��ø��ֻ�ѧ������������Щ���ʶԻ����IJ���Ӱ�졣
��1���о�����CO2�ŷ���һ����Ҫ���⡣CO2��������������ɵ�̼�л����Ҫ�����·�Ӧ��
��Ӧ����CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g) ��H1����49.6 kJ/mol
CH3OH(g)��H2O(g) ��H1����49.6 kJ/mol
��Ӧ����CH3OCH3(g)��H2O(g)![]() 2CH3OH(g) ��H2����23.4 kJ/mol
2CH3OH(g) ��H2����23.4 kJ/mol
��Ӧ����2CO2(g)��6H2(g)![]() CH3OCH3(g)��3H2O(g) ��H3
CH3OCH3(g)��3H2O(g) ��H3
�١�H3��____kJ/mol��
���ں㶨ѹǿ��T1�¶��£���6 mol CO2��12 mol H2����3 L���ܱ������з���I������Ӧ��5 min��Ӧ�ﵽƽ��״̬����ʱCH3OH(g) ���ʵ���Ϊ2mol��CH3OCH3(g)�����ʵ���Ϊ0.5mol����T1�¶�ʱ��ӦI��ƽ�ⳣ��Kc�ļ���ʽΪ______��
����ѹ�½�CO2��H2�������1��3��ϣ��ڲ�ͬ���������·�����ӦI�ͷ�ӦIII������ͬ��ʱ�����CH3OH��ѡ���ԺͲ������¶ȵı仯����ͼ �����У�CH3OH��ѡ���ԣ�![]() ��100%
��100%

�����������ºϳɼ״��Ĺ�ҵ������_____________��
A��210�� B�� 230�� C������CZT D������CZ(Zr��1)T
��2��һ�������£�����ͨ��CO��SO2��Ӧ����S��һ���������壬ʵ��ȼú��������Ļ��գ�д���÷�Ӧ�Ļ�ѧ����ʽ___________���ڲ�ͬ�����£���2L�����ܱ�������ͨ��2molCO��1molSO2����Ӧ��ϵ��ѹǿ��ʱ��ı仯��ͼ��ʾ��
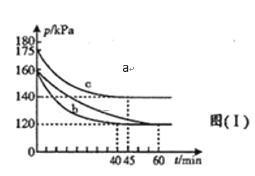
��ͼ������ʵ��ӷ�Ӧ��ʼ���ﵽƽ��ʱ����Ӧ����v(CO)����Ϊ_____������ţ���
����ʵ��a��ȣ�c��ı��ʵ������������___________��
��3�����������η������������е�SO2�����������£�������ͨ��(NH4)2SO3��Һ�У������ҺpH�뺬��������ʵ��������ı仯��ϵ��ͼ��ʾ��b��ʱ��ҺpH=7����n(NH4+)��n(HSO3)=________��
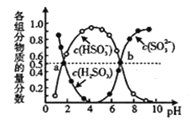
��4����ӵ绯ѧ���ɳ�NO����ԭ����ͼ��ʾ��д�����������ĵ缫��Ӧʽ����������Һ�����ԣ�_____��
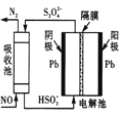
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������(��ZnS2O4)�ڹ�ҵ������Ư�����ⶾ�����������ȣ���;ʮ�ֹ㷺��
��.��ȡZnS2O4��Һ�;���
����3545�����з�Ӧ,ԭ��Ϊ��Zn+2SO2=ZnS2O4��
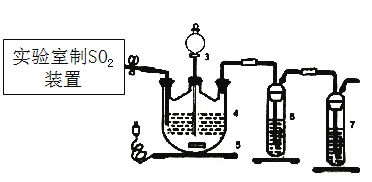
��1�����������Ʊ�SO2�ķ��������ѡ����___________��
��2��ֹͣ�����,����3����һ�����Ҵ�,�Ƶ�ZnS2O4���壬��Ҫԭ����_________��
��.�ⶨ����
��3������4�м���mgп����һ������ˮ������Ȳ���������������5��һ��ʱ�������������ȫ��ʧʱ���رջ�����ֹˮ�С�ȡZnS2O4�����ʮ��֮һ������������У���������ˮ��ͨ��������ʹ��ǡ��ת��ΪZn(HSO4)2��Zn(HSO3)2���壬Ȼ��������������ᣬͨ���ⶨ������������������ZnS2O4����IJ��ʡ���ش�����������⣺
���ⶨװ���У�����A�����ã�һ��________������________��
��Ϊ��߲ⶨ��ȷ�ȣ�����B������ѡ��_____________��
A.����ʳ��ˮ B.����NaHSO3��Һ C. ���ͳ���ʯ��ˮ D.98.3%��Ũ����
����ͼ�������ܶ���Ϊ��㣬���յ����Ϊ17.60mL����ʵ���¶�������Ħ�����ΪVmL.mol-1���ɵó�ZnS2O4�IJ���Ϊ ____________%��
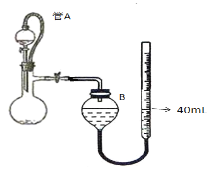
��4�������Ӧ�¶ȳ���45��,�ᵼ��ZnS2O4�ֽ�,����4���л�ɫ��������ɫ�����Ұ�������������,��ZnS2O4�ֽ�Ļ�ѧ����ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
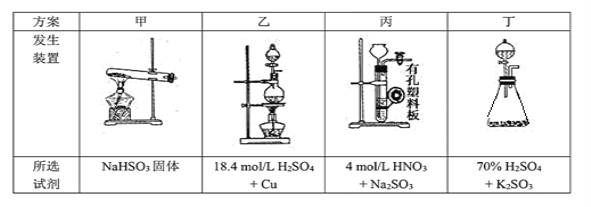
����Ŀ��������ʵ��װ�ý�����Ӧʵ�飬װ����ȷ���ܴﵽʵ��Ŀ�ĵ���( )
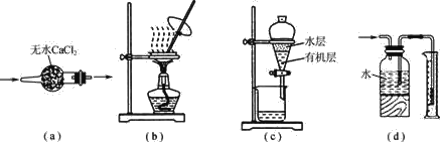
A.��ͼa��ʾװ�ø���SO2����
B.��ͼb��ʾװ������CH3COONa��Һ�ô����ƾ���
C.��ͼc��ʾװ�÷����л�����ˮ�㣬ˮ��ӷ�Һ©���¿ڷų�
D.��ͼd��ʾװ�ò������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com