
【题目】合金是一类用途广泛的金属材料,下列物质中属于合金的是( )
A. 钢 B. 水银 C. 金刚石 D. 四氧化三铁
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是六种核电荷数依次增加的短周期元素,它们位于三个不同的周期,B原子的电子数是最内层电子数的三倍,C和E位于同一主族且它们可形成EC2、EC3两种常见化合物,D的最髙价氧化物对应的水化物是强碱,E和F相邻。回答下列问题:
(1)写出B在元素周期表中的位置___________;
(2)写出A、C、F三种元素组成的一种弱电解质的结构式___________;
(3)能说明非金属性F比E强的两个实例_______、___________;
(4)化合物DA遇水会发生剧烈的化学变化,请写出该反应的化学方程式_____________;
(5)金属镁在BC2中燃烧的化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向FeI2,FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。已知:2Fe2++Br2===2Fe3++2Br-,2Fe3++2I-===2Fe2++I2。则下列有关说法中,不正确的是( )。

A. 线段BD表示Fe3+物质的量的变化
B. 原混合溶液中FeI2的物质的量为1mol
C. 当通入2 mol Cl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
D. 原溶液中:n(Fe2+)∶n(I-)∶n(Br-)=2∶3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】薄荷油中含有少量的a-非兰烃可以通过下列过程制得聚丙烯酸甲酯(H):

![]()
![]()
![]() +RˊCOOH
+RˊCOOH

![]()
![]() +CO2
+CO2
(1)写出a-非兰烃的结构简式___________。写出C—M的反应类型___________。
(2)下面是对于A、B、C、D的性质描述,其中正确的是___________(填标号)。
a.lmol A 可与2molNaHCO3反应放出2molCO2
b.lmolB可与2molH2发生加成反应
c.C可以发生缩聚反应
d.检验D的卤素原子种类可与NaOH水溶液共热后再加AgNO3溶液
(3)N的同分异构体中能同时满足下列两个条件的共有___________种(不含立体异构);其中核磁共振氢谱显示4组峰,且峰面积之比为4∶3∶2∶1的是___________(写结构简式)。
①含有一个六元环
②六元环上只有两个取代基,且环上每个碳原子最多只能有一个取代基
(4)E在一定条件下发生聚合反应可得到一种高级吸水树脂,写出生成该树脂反应的
化学方程式___________。
(5)写出F→G反应的化学方程式___________。
(6)BrCH2CH2CH2OH和甲醇也可以用来合成聚丙烯酸甲酯(H),写出合成路线___________(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件,合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)。
目标产物)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,若用如下图所示实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别是为石墨和铁。

试完成下列问题:
(1)a电极材料是_____。电解质溶液d若为______(填字母),则白色沉淀在电极上生成,此时a电极的电极反应式为_________________________;电解质溶液d若为____(填字母),则白色沉淀在两极之间的溶液中生成,若这种情况下,电路中有0.4mol电子通过,则理论上生成Fe(OH)2的质量为_______g。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(2)液体c为苯,所起的作用是__________________________,在加入苯之前,对d溶液进行加热处理的目的是__________________。
(3)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为________,发生反应的方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取A克铝粉和Fe2O3粉末组成的铝热剂,在隔绝空气的条件下加热使之充分反应。将反应后所得混合物研细,加入足量的氢氧化钠溶液,反应完全后放出气体0.672L;另取A克相同的铝热剂与足量稀硫酸作用,反应产生3.36L气体(上述气体体积均已换算成标准状况)。
(1)A克铝热剂中铝的物质的量为 mol。
(2)A克铝热剂发中铝热反应,生成铁的质量为 g。
(3)计算该铝热剂中铝粉的质量分数(结果准确到0.1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A. 用KIO3氧化酸性溶液中的KI: 5I-+IO3-+3H2O=3I2+6OH-
B. 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
C. 将过量SO2通入冷氨水中:SO2+NH3·H2O=HSO3-+NH4+
D. 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期的元素单质及其化合物有广泛的用途,请根据相关知识回答下列问题:
(1)原子最外层电子数是核外电子总数![]() 的元素,其原子结构示意图为________________;还原性最弱的简单阴离子__________ (填离子符号)。
的元素,其原子结构示意图为________________;还原性最弱的简单阴离子__________ (填离子符号)。
(2)晶体硅(熔点1410℃)是良好的半导体材料,可通过如图所示过程制备:
![]()
在上述由SiCl4制纯硅的反应中, 测得每生成2.8kg纯硅需要吸收akJ热量,请写出该反应的热化学方程式___________________。
(3)氯化铝的水溶液可用于净水,其原因是_________ (用离子方程式表示)。
工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)来制取无水氯化铝的一种工艺流程如图所示:
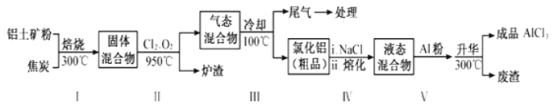
已知:
物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 | Al2O3 | Fe2O3 | SiO2 |
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 | 2980 | 3414 | 2230 |
①工业制铝时,电解Al2O3而不电解AlCl3的理由是____________。
② 步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多, 其作用是_________ (只要求写出一种)。
③步骤Ⅱ中若不通入氯气和氧气,则生成相对原子质量比硅大的单质______________。
④尾气经冷却至室温后用足量的KOH浓溶液吸收,生成的盐中除了K2CO3外,还有3种,其化学式分别为________________;其中一种盐可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:________________。
⑤结合流程及相关数据分析,步骤V中加入铝粉的目的是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com