
【题目】某1L待测溶液中除含有0.2mol/L的Na+外,还可能含有下列离子中的一种或多种:K+、NH4+、Fe3+、Ba2+、Cl-、Br-、CO32-、HCO3-、SO32-、SO42-。现进行如下实验操作(每次实验所加试剂均过量):
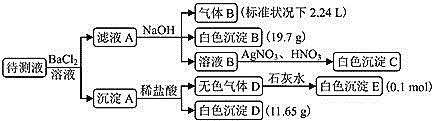
下列说法正确的是
A.待测液中一定含有NH4+、HCO3-和Cl-
B.待测液中一定没有Fe3+和Ba2+,可能含有Br-
C.生成白色沉淀B的离子方程式为:![]()
D.待测液中一定含有K+,且c(K+)=0.1mol/L
【答案】C
【解析】
加入BaCl2生成部分不溶于稀盐酸的白色沉淀,再综合给的阴离子可知待测液中含有SO42-,又因为部分白色沉淀能溶于稀盐酸并产生无色气体,可知待测液中还含有CO32-或SO32-或CO32-和SO32-,故待测液中一定含有SO42-,CO32-和SO32-至少含有一种,因为阳离子中Ba2+、Fe3+会与CO32-和SO32-反应生成沉淀,所以待测液中一定不含Ba2+、Fe3+,加入NaOH溶液后能产生气体,可知该气体为氨气,因而待测液中含有NH4+,加入BaCl2溶液不产生沉淀,滤液加入NaOH溶液后又生出白色沉淀,可知白色沉淀为BaCO3,可推知待测液中含有HCO3-,因待测液中加入BaCl2,所以溶液B中加入硝酸银产生白色沉淀不能判断待测液中是否含有氯离子,因溴化银为淡黄色沉淀,所以待测液中无Br-,白色沉淀B为BaCO3,气体B为NH3,白色沉淀E为CaCO3,白色沉淀D为BaSO4,且待测液中含有0.1molHCO3-、0.1molNH4+、0.1molCO32-、0.05molSO42-。
A.由以上分析可知,待测液中不能确定是否含有Cl-,A项错误;
B.由以上分析可知,待测液中一定没有Fe3+、Ba2+和Br-,B项错误;
C.由以上分析可知,生成白色沉淀B的离子方程式为:![]() ,C项正确;
,C项正确;
D.根据电荷守恒,溶液中一定含有K+,待测液中不能确定是否含有Cl-,假设不含Cl-,则根据溶液电中性原则可得待测液中K+最小浓度为0.1molL-1,D项错误。
答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NO等有害气体。
(1)汽车尾气中NO生成过程的能量变化如图示。1molN2和1molO2完全反应生成NO会____(填“吸收”或“放出”)____kJ能量。

(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:(提示:O2-可在此固体电解质中自由移动)

①NiO电极上发生的是___________反应(填“氧化”或“还原”)。
②外电路中,电子是从_________电极流出(填“NiO”或“Pt”).
③Pt电极上的电极反应式为________________________。
(3)一种新型催化剂用于NO和CO的反应:2NO+2CO![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
实验编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10﹣3 | 5.80×10﹣3 | 82 |
Ⅱ | 280 | 1.2×10﹣3 | b | 124 |
Ⅲ | 350 | a | 5.80×10﹣3 | 82 |
①请将表中数据补充完整:a ___________。
②能验证温度对化学反应速率规律的是实验____________(填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线_______(填“甲”或“乙”)。

(4)在容积固定的绝热容器中发生反应2NO+2CO2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.2υ逆(NO)=υ正(N2) D.容器内混合气体密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国汽车年销量的大幅增加,给空气环境造成了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )

A. 反应中NO为氧化剂,N2为氧化产物
B. 汽车尾气的主要污染成分包括CO、NO和N2
C. NO和O2必须在催化剂表面才能反应
D. 催化转化总化学方程式为2NO+O2+4CO ![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中医典籍《肘后备急方》所载治疗疟疾的方法“青蒿一握,以水二升渍,绞取汁,尽服之”, 对屠呦呦团队研发治疗疟疾的特效药——青蒿素有巨大的启示作用。屠呦呦在对比实验中发现古法疗效低下,她设计的提取青蒿素的工艺可以简化成如下流程:
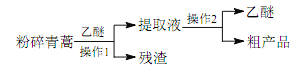
根据上述信息分析,下列判断或叙述中肯定错误的是
A. 从天然植物中提取有效成分治疗疾病是药物研发的重要途径
B. 将青蒿粉碎可以提高有效成分的提取率
C. 青蒿素易溶于水和乙醚
D. 操作 1 是过滤,操作 2 是蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁﹣次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO﹣+H2O═Mg(OH)2+Cl﹣下列有关说法正确的是( )

A. 电池工作时,C溶液中的溶质是MgCl2
B. 电池工作时,正极a附近的pH将不断增大
C. 负极反应式:ClO﹣﹣2e﹣+H2O═Cl﹣+2 OH﹣
D. b电极发生还原反应,每转移0.1mol电子,理论上生成0.1mol Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1molL-1NaOH溶液滴定20ml0.1molL-1H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH)。下列说法正确的是( )

A.a点所得溶液中:2c(HSO3-)+c(SO32-)=0.1mol/L
B.b点所得溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
C.c点所得溶液中:c(Na+)>3c(HSO3-)
D.d点所得溶液中:c(Na+)>c(OH-)>c(SO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A的分子量为92且所有碳原子都在同一平面上。一种由烃A制备水杨酸的过程如下∶
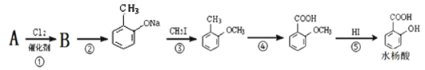
(1)请写出由B生成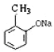 的反应方程式∶_________________________________;
的反应方程式∶_________________________________;
(2)在合成线路中,设计第③和第⑤这两步反应的目的是∶_____________________。
(3)若与水杨酸相关的转化关系如下∶
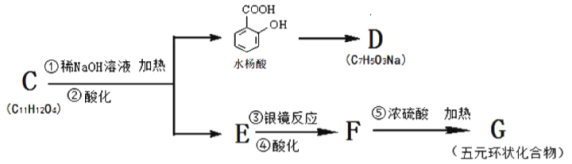
请用一个化学反应证明水杨酸中两官能团酸性差异∶____________________。
(4)①反应类型为∶_________、___________;
(5) G的结构简式为∶___________; 官能团名称∶_____________;
(6)请写出同时符合下列要求的水杨酸的所有同分异构体的结构简式______________。
①滴入FeCl3溶液,发生显色反应;
②能发生银镜反应∶
③苯环上一氯代物有两种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Ag2CrO4在不同浓度CrO42-溶液中的溶解度如图所示,下列说法正确的是![]()
![]()
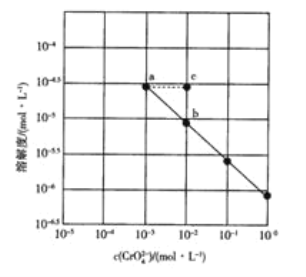
A.图中a、b两点c(Ag+)相同
B.图中a点Ag2CrO4的溶度积比b点的大
C.在a点向溶液中加如入少量AgNO3,溶解度可变为c点
D.该温度下,Ag2CrO4溶度积的数量级为10-12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应C(s)+H2O(g)![]() CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施不能使平衡发生移动的是( )
CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施不能使平衡发生移动的是( )
①增加C的物质的量 ②保持体积不变,充入N2使体系压强增大 ③将容器的体积缩小一半 ④保持压强不变,充入N2使容器体积变大
A. ①② B. ②③ C. ①④ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com