
| A、乙烯通入溴水使之褪色 |
| B、乙烯使酸性高锰酸钾溶液褪色 |
| C、四氯化碳与溴水混合振荡,静置后溴水褪色 |
| D、在催化剂作用下生成聚乙烯 |


科目:高中化学 来源: 题型:
| A、氨气通入醋酸溶液CH3COOH+NH3═CH3COONH4 |
| B、金属钠跟水反应Na+H2O═Na++OH-+H2↑ |
| C、碳酸钡溶于醋酸BaCO3+2H+═Ba2++H2O+CO2↑ |
| D、澄清的石灰水跟盐酸反应H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 |
| B、得电子越多的氧化剂,其氧化性就越强 |
| C、反应前各原子的物质的量之和一定等于反应后各原子的物质的量之和 |
| D、溶液稀释前溶质的物质的量一定等于溶液稀释后溶质的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
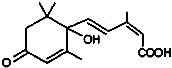 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开,S-诱抗素的 分子结构如图,下列关于该分子的说法中正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开,S-诱抗素的 分子结构如图,下列关于该分子的说法中正确的是( )| A、含有碳碳双键、羟基、羰基、羧基 |
| B、能发生加成反应、氧化反应、取代反应、缩聚反应 |
| C、1mol该分子能与含2mol NaOH的溶液完全反应 |
| D、该分子能与溴水反应而使溴水褪色且1mol它能与溴水中的4mol Br2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸 | B、NaCl |
| C、碱石灰 | D、CaO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5 mol/L |
| B、1mol/L |
| C、1.5 mol/L |
| D、2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2S>SO2>I->Br- |
| B、I->Br->SO2>H2S |
| C、H2S>I->Br->SO2 |
| D、I->Br->H2S>SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸溶解水垢(主要成分是碳酸钙)CaCO3+2H+→CO2↑+Ca2++H2O | ||
| B、高级脂肪酸与氢氧化钠溶液反应:H++OH-=H2O | ||
| C、苯酚钠溶液中通入少量CO2:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | ||
D、乙醛与银氨溶液的反应:CH3CHO+2[Ag(NH3)2]++2OH-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 硼、碳、硅元素的单质及其化合物的构成自然界的重要物质.请回答下列问题:
硼、碳、硅元素的单质及其化合物的构成自然界的重要物质.请回答下列问题:| CaO或MgO |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com