
【题目】一定温度下,在冰醋酸加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.下列说法正确的是( ) 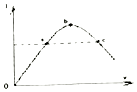
A.a、c两点pH不同
B.向c溶液中加水,溶液中所有离子浓度都减小
C.误用湿润的pH试纸测b点pH结果偏大
D.![]() b点大于c点
b点大于c点
【答案】C
【解析】解:A、由图可知a、c两点导电能力相同,所以氢离子的浓度相同,而不是不同,故A错误;B、向c溶液中加水,溶液中氢离子的浓度减小,但氢离子与氢氧根离子的积是个定值,所以氢氧根离子的浓度增加,故B错误;
C、湿润的pH试纸,相当于给原溶液稀释,所以测b点pH结果偏大,故C正确;
D、 ![]() 相当于醋酸根离子和醋酸的物质的量之比,加水稀释,醋酸的物质的量减小,而醋酸根离子的物质的量增强,所以b点小于c点,故D错误;
相当于醋酸根离子和醋酸的物质的量之比,加水稀释,醋酸的物质的量减小,而醋酸根离子的物质的量增强,所以b点小于c点,故D错误;
故选C.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】下列实验事实与原子结构模型建立的关系正确的是
A.阴极射线实验发现电子:道尔顿原子结构模型
B.α粒子散射实验发现原子核:卢瑟福原子结构模型
C.氢原子光谱发现电子分层排布:卢瑟福原子结构模型
D.α粒子散射实验发现电子:汤姆生原子结构模型
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,科学家发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能而成为当前生命科学的研究热点,NO亦被称为“明星分子”。回答下列问题:
(1)NO对环境的危害主要是_________。
A.破坏臭氧层 B.高温下能使一些金属被氧化
C.形成酸雨 D.与人体血红蛋白结合
(2)在含Cu+的酶的活化中心,亚硝酸根离子(NO2-)可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式:__________________________。
(3)常温下,在一个体积固定的容器里,把NO气体压缩到100个大气压。将容器中气体加热到50℃,发现气体的压强迅速下降,至略小于下降前压强的 ![]() 时就不再变化,已知其中一种产物为N2O ,写出上述变化的化学方程式:_______________。
时就不再变化,已知其中一种产物为N2O ,写出上述变化的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉、铜粉加入到盛有FeCl3、FeCl2、CuCl2的混合液的烧杯中,判断下列情况烧杯中的固体及金属阳离子(用化学式表示):
(1)若反应后铁粉有剩余,则一定有______________。
(2)若反应后有Cu2+和Cu,则不可能有_________。
(3)若反应后有Cu2+和Fe3+,则一定有_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( ) 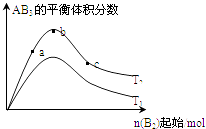
A.反应速率a>b>c
B.若T2>T1 , 则正反应一定是吸热反应
C.达到平衡时,AB3的物质的量大小为:b>c>a
D.达到平衡时A2的转化率大小为:b>a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
B. 电解饱和食盐水:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C. 硫酸铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓
D. 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2=Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,某平衡体系中含有X,Y,Z,W四种物质,此温度下发生反应的平衡常数表达式为K= ![]() .有关该平衡体系的说法正确的是( )
.有关该平衡体系的说法正确的是( )
A.当混合气体的平均相对分子质量保持不变时,反应达平衡
B.增大压强,各物质的浓度不变
C.升高温度,平衡常数K增大
D.增加X的量,平衡既可能正向移动,也可能逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年10月12日北京时间上午9时,中国酒泉卫星发射中心成功将“神舟6号”飞船送入太空,这一壮举又一次受到世界关注.火箭推进器中有强还原剂液体肼(N2H4)和强氧化剂液态双氧水.当它们混合时,即产生大量氮气和水蒸气并放出大量热.已知:0.4mol液态肼与足量的液态双氧水反应生成氮气和水蒸气,放出256.652kJ的热量.
(1)反应的热化学方程
(2)又已知H2O(l)=H2O(g)△H=44kJ.mol﹣1 . 则16g液态肼与足量的液态双氧水反应生成氮气和液态水时放出的热量是kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大优点是 .
(4)燃料电池在航天器得到大量应用;科研人员新近开发出一种由甲醇、氧气以及强碱作电解质溶液的新型手机电池,充电一次可供手机连续使用一个月,据此请回答以下问题:
①甲醇是极,电极反应
②电池反应的离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com