
【题目】常温下,等体积等pH的盐酸和醋酸两溶液,下列说法正确的是![]()
![]()
A.分别与适量且等量的锌粒反应,平均反应速率前者大
B.两溶液导电能力相同
C.分别与等浓度的氢氧化钠溶液反应至中性,消耗的氢氧化钠的体积相同
D.稀释10倍后,盐酸的pH比醋酸溶液的pH小
【答案】B
【解析】
A.等体积等pH的盐酸和醋酸两溶液,醋酸存在电离平衡,醋酸溶质浓度大于盐酸,随反应进行此时又电离出氢离子;
B.导电能力取决于溶液中离子浓度大小;
C.分别与等浓度的氢氧化钠溶液反应至中性,消耗的氢氧化钠的体积醋酸多;
D.稀释10倍后醋酸溶液pH减小的少。
A. 等体积等pH的盐酸和醋酸两溶液,醋酸存在电离平衡,醋酸溶质浓度大于盐酸,随反应进行此时又电离出氢离子,分别与适量且等量的锌粒反应,平均反应速率后者大,故A错误;
B. 常温下,等体积等pH的盐酸和醋酸两溶液中离子浓度相同,导电能力相同,故B正确;
C. 分别与等浓度的氢氧化钠溶液反应至中性,醋酸浓度大于盐酸,消耗的氢氧化钠溶液的体积不相同,故C错误;
D. 稀释10倍后,醋酸又电离出氢离子,盐酸的pH比醋酸溶液的pH大,故D错误;
故答案为:B。


科目:高中化学 来源: 题型:
【题目】Ⅰ.室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略混合后溶液的体积变化),实验数据如下表:
实验序号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
请回答:
(1)HA溶液和KOH溶液反应的离子方程式为________。
(2)实验①反应后的溶液中由水电离出的c(OH-)=________mol·L-1;x________0.2mol·L-1(填“>”“<”或“=”)。
(3)下列关于实验②反应后的溶液说法不正确的是________(填字母)。
a.溶液中只存在着两个平衡
b.溶液中:c(A-)+c(HA)>0.1mol·L-1
c.溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
Ⅱ.已知2H2(g)+O2(g)=2H2O(1) ΔH=-572kJ·mol-1。某氢氧燃料电池以疏松多孔石墨棒为电极,KOH溶液为电解质溶液。
(4)写出该电池工作时负极的电极反应式________。
(5)若该氢氧燃料电池每释放228.8kJ电能时,会生成1mol液态水,则该电池的能量转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼(C2H8N2)是一种高能燃料,可作为航天运载火箭的推动力。下列叙述正确的是( )
A.偏二甲肼的摩尔质量为60 g
B.6.02×1023个偏二甲肼分子的质量约为60 g
C.常温下,22.4L偏二甲肼气体的含C质量为24g
D.6 g偏二甲肼含有NA个N2 分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法不正确的是( )
)是最简单的一种。下列关于该化合物的说法不正确的是( )
A.与环戊烯互为同分异构体
B.二氯代物超过两种
C.所有碳原子均处同一平面
D.1mol螺[2,2]戊烷充分燃烧需要7molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂解可得烃D,其产量是一个国家石油化工发展水平的标志,已知D在标准状况下的密度为1.25 g·Lˉ1。有机物B可利用植物秸秆来生产,E为有香味的油状液体,它们之间的转化关系如图,请回答:

(1)C中所含官能团名称是____。
(2)写出反应④的化学方程式____。
(3)C与D在一定条件下可发生加成反应,生成具有酸性的物质F。F的结构简式为___。
(4)下列说法正确的是____。(填编号)
A.有机物E与F互为同分异构体
B.用新制氢氧化铜悬浊液无法区分有机物B和C
C.有机物A、D均能被酸性高锰酸钾溶液氧化
D.可用饱和NaOH溶液除去有机物E中混有的少量B、C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列过程的化学用语表述正确的是
A.把钠加入水中,有气体生成:2Na + H2O = Na2O+H2↑
B.用稀硫酸做导电实验,灯泡发光: H2O![]() H++OH-
H++OH-
C.向Al2(SO4)3溶液中滴加氨水,生成白色沉淀:Al3+ + 3OH- =Al(OH)3↓
D.用电子式表示NaCl的形成过程:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按如图所示操作,充分反应后:

①Ⅰ中发生反应的离子方程式为_____________________________________________;
②Ⅱ中铜丝上观察到的现象是________________________________________________;
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为______________________。
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应物中还原产物是____________;若反应方程式中转移了0.3 mol电子,则氧化产物的质量是________g。
(3)将少量Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-,这个事实说明具有还原性的粒子还原性强弱为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,密闭容器中发生反应:A(g)+3B(g) ![]() 2C(g),下列有关说法正确的是
2C(g),下列有关说法正确的是
A.若加入催化剂,则反应的△H 增大
B.加压时,平衡向正反应方向移动,反应的平衡常数增大
C.若反应温度升高,则活化分子的百分数增大,反应速率增大
D.若低温时,该反应为正向自发进行,则△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
铜及其化合物在生产生活中有着广泛的应用。请回答下列问题:
(1)铜元素位于元素周期表中第四周期________族,属于元素周期表中________区元素,基态Cu原子有___________种不同能级的电子。
(2)元素铜与镍的第二电离能分别为:ICu=1958 kJ·mol-1、INi=1753 kJ·mol-1, ICu>INi的原因是________________________________________________________。
(3)硫化亚铜和氧化亚铜均为离子晶体,二者比较,熔点较高的是氧化亚铜,原因为_________________________________________。
(4)某含铜化合物的离子结构如图1所示。
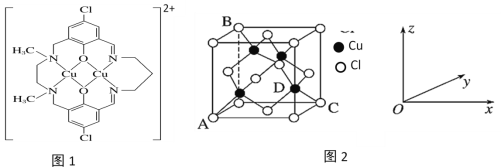
①该离子中存在的作用力有______________(填标号)。
A.离子键 B.共价键 C.配位键 D.氢键 E.范德华力
②该离子中碳原子的杂化类型有____________。
(5)CuCl2和CuCl是铜的两种氯化物。
①图2中表示的是________(填“CuCl2”或“CuCl”)的晶胞。
②原子坐标参数可用来表示晶胞内部各原子的相对位置。图2中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为____________。
③已知图2所示晶胞中C、D两原子核间距为298pm,阿伏加德罗常数的值为NA,则该晶体密度为___________________ g·cm-3(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com