
【题目】Ⅰ.室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略混合后溶液的体积变化),实验数据如下表:
实验序号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
请回答:
(1)HA溶液和KOH溶液反应的离子方程式为________。
(2)实验①反应后的溶液中由水电离出的c(OH-)=________mol·L-1;x________0.2mol·L-1(填“>”“<”或“=”)。
(3)下列关于实验②反应后的溶液说法不正确的是________(填字母)。
a.溶液中只存在着两个平衡
b.溶液中:c(A-)+c(HA)>0.1mol·L-1
c.溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
Ⅱ.已知2H2(g)+O2(g)=2H2O(1) ΔH=-572kJ·mol-1。某氢氧燃料电池以疏松多孔石墨棒为电极,KOH溶液为电解质溶液。
(4)写出该电池工作时负极的电极反应式________。
(5)若该氢氧燃料电池每释放228.8kJ电能时,会生成1mol液态水,则该电池的能量转化率为________。
【答案】HA+OH-=A-+H2O 1×10-5 > a H2+2OH--2e-=2H2O 80%
【解析】
Ⅰ.(1)等浓度和等体积的HA溶液和KOH溶液混合后溶液显碱性,说明HA为弱酸,则HA溶液和KOH溶液反应的离子方程式为HA+OH-=A-+H2O;
(2)实验①反应后的溶液的pH=9,溶液中OH-来源于水,由水电离出的c(OH-)=![]() mol·L-1=1×10-5mol·L-1;若该酸为强酸,等体积等浓度混合时pH=7,而HA为弱酸,等体积等浓度混合溶液的pH大于7,则为保证pH=7,应使酸浓度应该大于0.2mol/L;
mol·L-1=1×10-5mol·L-1;若该酸为强酸,等体积等浓度混合时pH=7,而HA为弱酸,等体积等浓度混合溶液的pH大于7,则为保证pH=7,应使酸浓度应该大于0.2mol/L;
(3)a.实验②反应后溶液中只存在HA的电离、水的电离及A-的水解平衡,故a错误;
b.酸浓度大于0.2mol/L,根据物料守恒c(A-)+c(HA)>0.1mol·L-1,故b正确;
c.溶液的pH=7,结合电荷守恒可得c(K+)=c(A-)>c(OH-)=c(H+),故c正确;
答案为a。
Ⅱ.(4)在氢氧燃料电池的负极上发生失电子的氧化反应,即H2+2OH--2e-=2H2O;
(5)H2(g)+![]() O2(g)=H2O(l)△H=-286kJmoL-1,氢氧燃料电池释放228.8kJ电能时,生成1mol液态水,该电池的能量转化率为
O2(g)=H2O(l)△H=-286kJmoL-1,氢氧燃料电池释放228.8kJ电能时,生成1mol液态水,该电池的能量转化率为![]() ×100%=80%;
×100%=80%;


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】CaCl2固体遇 NH3会形成 CaCl2 8 NH3(可溶于水)。下列说法不正确的是
A.CaCl2 作干燥剂时,不能干燥 NH3
B.CaCl2 8 NH3溶于水,溶液呈中性
C.CaCl2 8 NH3溶于水,通少量CO2 会产生白色沉淀
D.CaCl2 与 NH3形成CaCl2 8 NH3的过程属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某同学采用萃取—分液的方法从碘水中提取碘,主要操作步骤如下图:

①该同学所采用的萃取剂可能是______________(填序号)。
A 酒精 B 苯 C 四氯化碳 D 汽油
②甲、乙、丙3步实验操作中,不正确的是_______________(填“甲”、“乙”或“丙”)。
(2)实验室制取、净化并收集氯气涉及以下几个主要阶段:

现有以下2种试剂:A 饱和食盐水 B NaOH溶液
请在以上实际中选择填空(填“A”或“B”):
①X溶液应选用________________。
②尾气处理过程中,多余的氯气可用________________吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)![]() CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
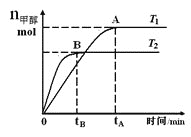
A. 平衡常数K=![]()
B. 该反应在T1时的平衡常数比T2时的小
C. CO合成甲醇的反应为吸热反应
D. 处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为从光盘中提取Ag(其它金属微量忽略不计)对废旧资源进行回收利用的工艺流程,下列说法错误的是( )
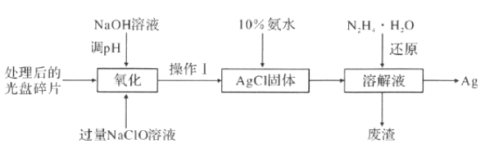
A.“氧化"阶段需在80 ℃条件下进行,则适宜的加热方式为水浴加热
B.“氧化“过程还生成O2,则反应方程式为4Ag+4NaClO+2H2O=4AgCl+ 4NaOH+O2↑
C.10%的氨水洛解AgCl团体,AgCl与NH3·H2O按1:2反应可生成Cl-和[Ag(NH3)2]+
D.“还原”过程中N2H4·H2O在碱性条件下转化为无害气体N2,则理论上生成22.4LN2可提取到43.2g的单质Ag。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO和CO2的利用对促进低碳社会的构建具有重要意义。请回答下列问题:
(1)利用CO和H2在一定条件下可合成甲醇,发生反应: CO(g)+ 2H2(g)![]() CH3OH(g),其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是_____(填字母)。
CH3OH(g),其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是_____(填字母)。
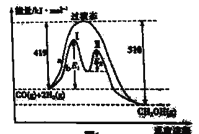
A.上述反应的△H= -91 kJ·mol-1
B.该反应自发进行的条件为高温
C. b过程使用催化剂后降低了反应的活化能和H
D. b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(2)若反应CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1L密闭容器中发生,反应过程中各物质的物质的量随时间变化见表所示:
CH3OH(g)在温度不变且体积恒定为1L密闭容器中发生,反应过程中各物质的物质的量随时间变化见表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是_______(填字母)
A.2v正(H2)=v逆(CH3OH)
B. CO与CH3OH的物质的量之比保持不变
C.混合气的平均相对分子质量保持不变
D.混合气体的密度保持不变
②若起始压强为P0kPa,反应速率若用单位时间内分压的变化表示,则10 min内H2的反应速率v(H2)=_____kPa/min;该温度下反应的平衡常数Kp=______。(分压=总压×物质的量分数)。
(3)甲和乙两个恒容密闭容器的体积相同,向甲中加入1 mol CO和2 mol H2,向乙中加入2 mol CO和4 molH2,测得不同温度下CO的平衡转化率如图所示,则L、M两点容器内平衡常数:K(M)_____ K(L); 压强:p(M)__2p(L)。(填“>”“<”或“=”)

(4)以纳米二氧化钛为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯(![]() )。电解时,阴极的电极反应式是_________。
)。电解时,阴极的电极反应式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在K2CO3样品中含Na2CO3、KNO3、Ba(NO3)2中的一或二种杂质.将13.8 g该样品溶于足量水中得到澄清溶液,再加入过量CaCl2溶液,可得9.0 g沉淀,则原样品中含有的杂质会是
A.肯定没有Na2CO3,Ba(NO3)2
B.肯定有Na2CO3,没有Ba(NO3)2
C.肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3
D.无法判断何种为肯定或否定的杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种物质,它们的相互转化关系如下图(反应条件略,有些反应的产物和反应的条件没有全部标出)。已知A、B、E是单质,其中A着火只能用干燥的沙土灭火,B在常温下为气体,C俗名称为烧碱,D为无色无味液体。

(1)写出A、B、F的化学式 A______ B ______ F ______。
(2)写出A和D反应生成B和C的化学方程式_____________。若生成3mol的B,则转移的电子数目为_______________ 。
(3)写出E与C、D反应生成的B和F离子方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,等体积等pH的盐酸和醋酸两溶液,下列说法正确的是![]()
![]()
A.分别与适量且等量的锌粒反应,平均反应速率前者大
B.两溶液导电能力相同
C.分别与等浓度的氢氧化钠溶液反应至中性,消耗的氢氧化钠的体积相同
D.稀释10倍后,盐酸的pH比醋酸溶液的pH小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com