
【题目】CaCl2固体遇 NH3会形成 CaCl2 8 NH3(可溶于水)。下列说法不正确的是
A.CaCl2 作干燥剂时,不能干燥 NH3
B.CaCl2 8 NH3溶于水,溶液呈中性
C.CaCl2 8 NH3溶于水,通少量CO2 会产生白色沉淀
D.CaCl2 与 NH3形成CaCl2 8 NH3的过程属于化学变化
科目:高中化学 来源: 题型:
【题目】KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+ Cl-+ H+(未配平)。已知该反应的速率随c(H+)的增大而加快。下图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图。下列说法正确的
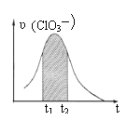
A. 反应开始时速率增大可能是c(H+)所致
B. 纵坐标为υ(Cl-)的υ-t曲线与图中曲线不能完全重合
C. 后期速率υ下降的主要原因是反应向逆反应方向进行
D. 图中阴影“面积”可以表示t1-t2时间内c(SO42-)增加量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减少环境污染,又能充分利用化学能,装置如图所示。下列说法正确的是( )

A.电流从电极A经过负载后流向电极B
B.为使电池持续放电,离子交换膜只允许阴离子通过
C.电极A的电极反应式为:2NH3-6e-=N2+6H+
D.室温下,当有4.48LNO2被处理时,转移电子为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于葛根素(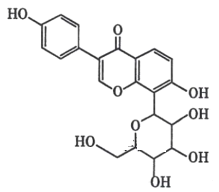 )的说法,正确的是
)的说法,正确的是
A.0.1 mol 葛根素完全燃烧,生成 22.4L(标准状况)H2O
B.1mol 葛根素与溴水反应,最多消耗 2.5mol Br2
C.一定条件下,葛根素能发生氧化、消去及水解等反应
D.与足量 H2 发生加成反应,该分子中官能团的种类减少 2 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应式:mX(g)+nY(?)![]() pQ (g)+2mZ(g),达到平衡时c( X) =0.3 mol L-1。其他条件不变,将容器体积缩小到原来的
pQ (g)+2mZ(g),达到平衡时c( X) =0.3 mol L-1。其他条件不变,将容器体积缩小到原来的![]() ,重新平衡后c(X) =0.5 mol L-1。下列说法正确的是
,重新平衡后c(X) =0.5 mol L-1。下列说法正确的是
A.平衡逆方向移动B.Y 可能是固体
C.系数n>mD.Z 的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙(如下图)三种晶体的晶胞(甲中x处于晶胞的中心,乙中a处于晶胞的中心),可推知:甲晶胞中x与y的个数比是__________,乙晶胞中a与b的个数比是__________,丙晶胞中有________个c离子,有________个d离子。
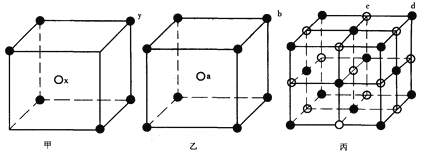
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以异丙苯为起始原料,按下列路线合成植物香料花青醛。

已知:(l)RX![]() RMgX
RMgX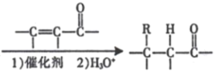 ( R 表示烃基);
( R 表示烃基);
(2)RCHO + R'CH2CHO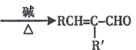 (R、R' 表示烃基或氢原子)。
(R、R' 表示烃基或氢原子)。
请回答:
(1)下列说法正确的是__________(填序号)。
A.异丙苯到化合物C 共经历了三步取代反应
B.常温常压下,化合物D可溶于NaOH 溶液
C.化合物B具有弱碱性
D.花青醛的分子式是C13H18O
(2)写出化合物E的结构简式___________。
(3)写出反应①的化学方程式___________。
(4)设计从乙烯到F 的合成路线(用流程图表示,无机试剂任选)_______。
(5)写出化合物A同时符合下列条件的同分异构体的结构简式______。1H-NMR谱和IR谱检测表明:
①分子中共有4种氢原子,有氮氢键;
②除苯环外不含其它环状结构,且无氮氧键、碳氮双键和氧氢键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究 2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+l0CO2↑+8H2O 反应速率的影响因素,有关实验数据如下表所示:
编号 | 温度 ℃ | 催化 剂(g) | 酸性KMnO4溶液 | H2C2O4溶液 | KMnO4溶液褪 色平均时间(min) | ||
体积(mL) | 浓度(mol/L) | 体积(mL) | 浓度(mol/L) | ||||
1 | 25 | 0.5 | 4 | 0.1 | 8 | 0.2 | 12.7 |
2 | 80 | 0.5 | 4 | 0.1 | 8 | 0.2 | a |
3 | 25 | 0.5 | 4 | 0.01 | 8 | 0.2 | 6.7 |
4 | 25 | 0 | 4 | 0.01 | 8 | 0.2 | b |
下列说法不正确的是
A.a<12.7,b>6.7
B.可通过比较收集相同体积CO2所消耗的时间来判断反应速率快慢
C.用H2C2O4表示该反应速率,v(实验1)约为6.6×l0-3 mol·L-1·min-1
D.用KMnO4表示该反应速率,v(实验3)>v(实验1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略混合后溶液的体积变化),实验数据如下表:
实验序号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
请回答:
(1)HA溶液和KOH溶液反应的离子方程式为________。
(2)实验①反应后的溶液中由水电离出的c(OH-)=________mol·L-1;x________0.2mol·L-1(填“>”“<”或“=”)。
(3)下列关于实验②反应后的溶液说法不正确的是________(填字母)。
a.溶液中只存在着两个平衡
b.溶液中:c(A-)+c(HA)>0.1mol·L-1
c.溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
Ⅱ.已知2H2(g)+O2(g)=2H2O(1) ΔH=-572kJ·mol-1。某氢氧燃料电池以疏松多孔石墨棒为电极,KOH溶液为电解质溶液。
(4)写出该电池工作时负极的电极反应式________。
(5)若该氢氧燃料电池每释放228.8kJ电能时,会生成1mol液态水,则该电池的能量转化率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com