
【题目】对下列过程的化学用语表述正确的是
A.把钠加入水中,有气体生成:2Na + H2O = Na2O+H2↑
B.用稀硫酸做导电实验,灯泡发光: H2O![]() H++OH-
H++OH-
C.向Al2(SO4)3溶液中滴加氨水,生成白色沉淀:Al3+ + 3OH- =Al(OH)3↓
D.用电子式表示NaCl的形成过程:![]()
科目:高中化学 来源: 题型:
【题目】研究CO和CO2的利用对促进低碳社会的构建具有重要意义。请回答下列问题:
(1)利用CO和H2在一定条件下可合成甲醇,发生反应: CO(g)+ 2H2(g)![]() CH3OH(g),其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是_____(填字母)。
CH3OH(g),其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是_____(填字母)。
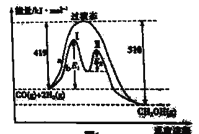
A.上述反应的△H= -91 kJ·mol-1
B.该反应自发进行的条件为高温
C. b过程使用催化剂后降低了反应的活化能和H
D. b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(2)若反应CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1L密闭容器中发生,反应过程中各物质的物质的量随时间变化见表所示:
CH3OH(g)在温度不变且体积恒定为1L密闭容器中发生,反应过程中各物质的物质的量随时间变化见表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是_______(填字母)
A.2v正(H2)=v逆(CH3OH)
B. CO与CH3OH的物质的量之比保持不变
C.混合气的平均相对分子质量保持不变
D.混合气体的密度保持不变
②若起始压强为P0kPa,反应速率若用单位时间内分压的变化表示,则10 min内H2的反应速率v(H2)=_____kPa/min;该温度下反应的平衡常数Kp=______。(分压=总压×物质的量分数)。
(3)甲和乙两个恒容密闭容器的体积相同,向甲中加入1 mol CO和2 mol H2,向乙中加入2 mol CO和4 molH2,测得不同温度下CO的平衡转化率如图所示,则L、M两点容器内平衡常数:K(M)_____ K(L); 压强:p(M)__2p(L)。(填“>”“<”或“=”)

(4)以纳米二氧化钛为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯(![]() )。电解时,阴极的电极反应式是_________。
)。电解时,阴极的电极反应式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是
A.向 CH2BrCOOH中加入足量的氢氧化钠溶液并加热:![]()
B.用氢氧化钠溶液除去铝片表面的氧化膜:Al3++4OH-→AlO2-+2H2O
C.次氯酸钠溶液中通入少量的CO2气体:ClO-+CO2+H2O→HClO+HCO3-
D.等体积、等浓度的Ca(HCO)2溶液和NaOH溶液混合:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面三种方法都可以制得Cl2:
①MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑
③O2+4HCl(g)  2H2O+2Cl2
2H2O+2Cl2
这三种氧化剂的氧化性由强到弱的顺序是( )
A.O2>MnO2>KMnO4
B.KMnO4>MnO2>O2
C.MnO2>KMnO4>O2
D.O2>KMnO4>MnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,等体积等pH的盐酸和醋酸两溶液,下列说法正确的是![]()
![]()
A.分别与适量且等量的锌粒反应,平均反应速率前者大
B.两溶液导电能力相同
C.分别与等浓度的氢氧化钠溶液反应至中性,消耗的氢氧化钠的体积相同
D.稀释10倍后,盐酸的pH比醋酸溶液的pH小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种离子,已知各离子的浓度均相等,进行如下实验:
中的几种离子,已知各离子的浓度均相等,进行如下实验:
![]() 取少量该溶液,加入足量稀硫酸,无明显现象。
取少量该溶液,加入足量稀硫酸,无明显现象。
![]() 取
取![]() 反应后的溶液,加入足量浓NaOH溶液,最终得到红褐色沉淀,并伴有刺激性气味气体产生。下列说法不正确的是
反应后的溶液,加入足量浓NaOH溶液,最终得到红褐色沉淀,并伴有刺激性气味气体产生。下列说法不正确的是![]()
![]()
A.该溶液中肯定不存在![]() 、
、![]() 、
、![]()
B.另取该溶液,加入适量氯水和淀粉溶液,若溶液显蓝色,即可确定该溶液中一定不含![]()
C.取原溶液进行焰色反应,显黄色,则溶液中一定含有的离子有六种
D.该溶液中肯定存在![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25oC时,浓度均为0.1 mol·L–1的几种溶液的pH如下:
溶液 | ①CH3COONa溶液 | ②NaHCO3溶液 | ③CH3COONH4溶液 |
pH | 8.88 | 8.33 | 7.00 |
下列说法不正确的是
A.①中, c(Na+) = c(CH3COO–) + c( CH3COOH)
B.由①②可知,CH3COO–的水解程度大于![]() 的水解程度
的水解程度
C.③中,c(CH3COO–) = c(NH4+) < 0.1 mol·L–1
D.推测25oC,0.1 mol·L–1 NH4HCO3溶液的pH <8.33
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,我国储氢碳管研究获得重大进展,电弧法合成碳纳米管,常伴有大量物质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
3C + 2K2Cr2O7 + 8H2SO4(稀)= 3CO2↑ + 2K2SO4 + 2Cr2(SO4)3 + 8 H2O
请回答下列问题。
(1)H2O的摩尔质量为___________,0.18g H2O的物质的量为_______________mol
(2)配制0.1mol/L H2SO4溶液500mL,则需要H2SO4的质量为_____________g
(3)在上述的反应中,若生成22g CO2
ⅰ.标准状况下,CO2的体积为_________L
ⅱ.转移电子的数目为________________
(4)标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,则该混合气体的平均相对分子质量是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上有重要的用途。硼镁泥是硼镁矿生产硼砂的废渣,其主要成分是MgCO3,还含有MgO、CaO、Fe2O3、FeO、MnO2、Al2O3、SiO2等杂质,工业上用硼镁泥制取七水硫酸镁的工艺流程如图:
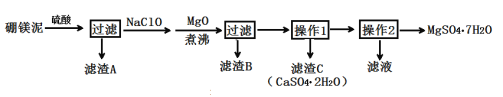
已知:①MnO2不溶于稀硫酸。
②CaSO4和MgSO4·7H2O在不同温度下的溶解度(g)数据如下表所示:
温度/℃ 物质 | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.21 | 0.19 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | —— |
(1)开始用到硫酸的质量分数为70%,密度为1.61g/cm3,则该硫酸溶液的物质的量浓度为___。
(2)滤渣A中除含少量CaSO4·2H2O外,还有___。
(3)加入MgO后,加热煮沸的目的是___。
(4)若滤渣B的主要成分为Al(OH)3和Fe(OH)3。则加入NaClO发生氧化还原反应的离子方程式为___。
(5)流程中操作1为蒸发浓缩、趁热过滤,这样即可得到CaSO4·2H2O,又防止___。
(6)获取MgSO4·7H2O的操作2为:___、___、过滤洗涤。
(7)已知开始硼镁泥样品的质量为ag,制取七水硫酸镁的质量为bg,据此能计算出硼镁泥中镁元素的含量吗?若能,请写出表达式;若不能,请说明理由。___(能或不能),表达式(或理由)为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com