
| 选项 | 现象或事实 | 解释 |
| A | 用热的纯碱溶液洗去油污 | Na2CO3可直接和油污反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| C | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl在土壤中反应生成氨气会降低肥效 |
| D | 钢铁在潮湿的空气中容易生锈 | 钢铁在空气中发生了析氢腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.油脂在碱性溶液中水解生成溶于水的物质,碳酸钠溶液水解显碱性;
B.漂白粉中有效成分次氯酸钙和空气中二氧化碳水反应生成次氯酸和碳酸钙,次氯酸见光分解,漂白粉在空气中久置变质;
C.碳酸钾和氯化铵在溶液中水解促进生成氨气,降低肥效;
D.钢铁在中性环境下发生吸氧腐蚀.
解答 解:A.油脂在碱性溶液中水解生成溶于水的物质,碳酸钠溶液水解生成氢氧化钠显碱性,Na2CO3 不可直接与油污反应,故A错误;
B.漂白粉中有效成分次氯酸钙和空气中二氧化碳、水反应生成次氯酸和碳酸钙,次氯酸见光分解,漂白粉失效,故B错误;
C.碳酸钾和氯化铵在溶液中水解促进生成氨气,降低肥效,施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用,故C正确;
D.钢铁在中性环境下发生吸氧腐蚀,在酸性条件下发生析氢腐蚀,故D错误;
故选C.
点评 本题考查化学实验方案的评价,涉及盐类水解的分析应用、金属腐蚀等,掌握物质性质和反应实质是关键,为高考常见题型,注意相关知识的学习与积累,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1.12 L CCl4含有C-Cl键的数目为0.2NA | |
| B. | 1 L 1 mol/L AlCl3溶液中含有NA个Al3+ | |
| C. | 常温常压下,4.4 g CO2与N2O的混合气体中含有的原子总数为0.3NA | |
| D. | 80 mL 10 mol•L-1盐酸与足量MnO2加热反应,产生的Cl2分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2A(l)+B(l)═2C(g);△H=+Q1 | B. | 2A(g)+B(g)═2C(g);△H=+Q2 | ||
| C. | 2A(g)+B(g)═2C(l);△H=+Q3 | D. | 2A(l)+B(l)═2C(l);△H=+Q4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
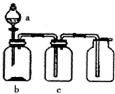 使用下表提供的试剂,利用如图所示的装置,能达到实验目的是( )
使用下表提供的试剂,利用如图所示的装置,能达到实验目的是( )| 选项 | a中试剂 | b中试剂 | c中试剂 | 实验目的 |
| A | 稀盐酸 | 铁粉 | H2O | 制备并收集H2 |
| B | 稀硫酸 | Na2SO3粉末 | 浓硫酸 | 制备并收集干燥的SO2 |
| C | 浓盐酸 | KmnO4粉末 | NaOH溶液 | 制备并收集Cl2 |
| D | 浓氨水 | 生石灰 | 碱石灰 | 制备并收集干燥的NH3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:| 元素 | 元素性质或原子结构 |
| A | 周期表中原子半径最小 |
| B | 原子核外有三种不同的能量的原子轨道且各个轨道所填充的电子数相同 |
| C | 最外层p轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E | 位于ds区且原子的最外层电子数与A的相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

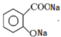
| 试剂 | 沸点(℃) | 溶解度 | 化学性质 |
| 乙酸酐 | 139 | 在水中逐渐分解 | 略 |
| 乙酰水杨酸 | 略 | 微溶于水 | 与碳酸钠反应生成水溶性盐 |
| 水杨酸 | 211 | 微溶于冷水,易溶于热水 | 略 |
| 乙酸 | 117.9 | 略 | 略 |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2017届广东省高三月考二化学试卷(解析版) 题型:简答题
2011年12月30日中国环境保护部通过了新修订的《环境空气质量标准》,调整了污染物项目及限值,增设了PM2.5平均浓度限值,收紧了NO2等污染物的浓度限值。
(1)①甲烷是一种清洁燃料,在一定条件下,发生反应:CH4(g)+H2O(g)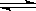 CO(g)+3H2(g) ΔH>0。将1.0 mol CH4和2.0 mol H2O通入反应容器(假设容积为10L),10 min末有0.10 mol CO生成,则10 min内该反应的速率v(H2)= 。②已知甲烷燃料电池的工作原理如右图所示。该电池中甲烷从 进(填“a”、“b”、“c”、“d”),电极Ⅰ是 极,写出该电池负极的电极反应: 。
CO(g)+3H2(g) ΔH>0。将1.0 mol CH4和2.0 mol H2O通入反应容器(假设容积为10L),10 min末有0.10 mol CO生成,则10 min内该反应的速率v(H2)= 。②已知甲烷燃料电池的工作原理如右图所示。该电池中甲烷从 进(填“a”、“b”、“c”、“d”),电极Ⅰ是 极,写出该电池负极的电极反应: 。

(2)某工厂利用尾气CO制甲醇,在一定压强和固定容积的容器中,通入a molCO与2a mol H2,在催化剂作用下反应:CO(g)+2H2(g) 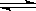 CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:

①P1 P2(填“<”、“>”或“=”)。
②下列各项中,不能说明该反应已达到平衡的是 。
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1 mol CO,同时生成l mol CH3OH
③如下图是该反应在不同温度下CO的转化率随时间变化的曲线。请分别画出在T1 、T2温度下,H2的浓度随时间变化的曲线

(3)某硝酸处理NO2方法是:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g) =-483.6kJ/mol
=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g) =+67.7kJ/mol
=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com