
����Ŀ��������Ҫ�Ļ�����Ʒ֮һ�����Ź㷺����;�����û�ѧ��Ӧԭ�������֪ʶ�о����ĺϳɼ����ʶԹ�ҵ��������ʮ����Ҫ���塣
I���ϳɰ��õ��������Լ���Ϊԭ���Ƶã�CH4(g)+H2O(g) ![]() CO(g)+3H2(g)���йػ�ѧ��Ӧ�������仯����ͼ��ʾ��CH4(g)��H2O (g)��Ӧ����CO (g)��H2 (g)���Ȼ�ѧ����ʽΪ______________��
CO(g)+3H2(g)���йػ�ѧ��Ӧ�������仯����ͼ��ʾ��CH4(g)��H2O (g)��Ӧ����CO (g)��H2 (g)���Ȼ�ѧ����ʽΪ______________��

II.�����£���һ����N2��H2����10L�������з�����Ӧ��N2(g)+3H2(g)![]() 2NH3(g) ��H=-92.0kJ/mol����Ӧ�����и����ʵ����ʵ�����ʱ��仯����ͼ��
2NH3(g) ��H=-92.0kJ/mol����Ӧ�����и����ʵ����ʵ�����ʱ��仯����ͼ��

��1��ͼ��0��2s�ڵķ�Ӧ����v(NH3)=______�����¶��´�ƽ��ʱN2��ת����Ϊ_____��
��2���������������䣬������������Ϊ��ѹ����ƽ��ʱc(N2)__��ƽ�ⳣ��___�������ţ�
A������ B����С C������ D������ȷ��
��3���ڲ�ͬ�¶��´ﵽƽ��ʱ���NH3������������±���ʾ��
T/�� | 200 | 300 | 400 |
NH3��������� | a1 | a2 | 38% |
���ԱȽ�a1��a2�Ĵ�С��a1_____a2���>������<����=������
������Ӧ�ں���400�������½��У��������жϷ�Ӧ�ﵽƽ��״̬��������____ (����)��
A������1molH-H��ͬʱ����2molN-H�� B��v��(N2)=3V��(H2)
C��������N2��H2��NH3�������ʵ���֮��Ϊ1:3:2 D��ƽ�ⳣ�����ֲ���
E����������ƽ����Է����������ֲ��� F�����������ܶȱ��ֲ���
��4����ҵ�Ϻϳɰ������˸��¸�ѹ�����������������ݷ�Ӧ�ж�������Щ������������߰��IJ���____��
A������400�桫500����� B�����ú��ʵĸ�ѹ
C��ʹ������ý������ D.����Һ������ϵ�з������
��5��������ȡ����[CO (NH2)2]�ķ�Ӧ��2NH3 (g) +CO2(g) ![]() CO (NH2)2 (1)+H2O (g)��
CO (NH2)2 (1)+H2O (g)��
�ٸ÷�Ӧ�¶����ߣ������İٷֺ����������H______0���>������<����=������
��CO��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ�� ������2mol NH3��1mol CO2��2L�ܱ������н��з�Ӧ����100��ʱ��Ӧ��ƽ�ⳣ��K=________��ѹǿ�Ĵ�С��ϵ��P1______P2���>������<������=����ȷ��������

���𰸡� CH4(g) +H2O (g) ![]() CO (g) +3H2 (g) ��H=+162kJ��mol 0.05mol��(L��s) 50% A C > AE BD < 4 >
CO (g) +3H2 (g) ��H=+162kJ��mol 0.05mol��(L��s) 50% A C > AE BD < 4 >
��������I����֪���٢�CO��g��+![]() O2��g��=CO2��g����H=-282KJ/mol���ڢ�H2��g��+
O2��g��=CO2��g����H=-282KJ/mol���ڢ�H2��g��+![]() O2��g��=H2O��g����H=-242KJ/mol���ۢ�CH4��g��+2O2��g��=CO2��g��+2H2O��g����H=-846KJ/mol���ɸ�˹���ɢ�-�ۡ�3-�ڵõ���CH4��g��+H2O��g��=CO��g��+3H2 ��g����H=+162kJmol-1��
O2��g��=H2O��g����H=-242KJ/mol���ۢ�CH4��g��+2O2��g��=CO2��g��+2H2O��g����H=-846KJ/mol���ɸ�˹���ɢ�-�ۡ�3-�ڵõ���CH4��g��+H2O��g��=CO��g��+3H2 ��g����H=+162kJmol-1��
II.��1������ͼ��1��֪������bΪ������Ũ�ȵı仯���ߣ���c��NH3��=![]() =0.1mol/L����v��NH3��=
=0.1mol/L����v��NH3��=![]() =
=![]() =0.05mol/��L��s�������¶��´�ƽ��ʱN2��ת����Ϊ
=0.05mol/��L��s�������¶��´�ƽ��ʱN2��ת����Ϊ![]() ��100%=50%��
��100%=50%��
��2����������ѹʱ���൱�����ں��ݴ�ƽ��Ļ�������ѹ�������������ƽ�����ƣ����������ģ����������ʵ�����С����Ũ�ȱȺ���ʱҪ��ʴ�ΪA���¶Ȳ��䣬ƽ�ⳣ�����䣬�ʴ�ΪC��
��3���ٸ��ݷ�Ӧ���ȣ������¶����ߣ�ƽ�����淴Ӧ�����ƶ����������������Ӧ�ñ�С����a1��a2��
��A������1molH-H��ͬʱ����2molN-H����˵�������������淴Ӧ��������Ҳ�Ϊ0����Ϊƽ��״̬����A��ȷ��B��v��(N2)=3V��(H2)ʱ����˵�������������淴Ӧ������ȣ�����ȷ����ƽ��״̬����B����C��������N2��H2��NH3�����ʵ���֮��Ϊ1:3:2����ʱ��һ��Ϊƽ��״̬����C����D�����������£�ƽ�ⳣ��ʼ�ձ��ֲ��䣬��ʱ��һ��Ϊƽ��״̬����D����E����������������䣬�����ʵ�����ȷ��������������ƽ����Է����������ֲ���ʱ��˵�����������ʵ������ٸı䣬��Ϊƽ��״̬����E��ȷ��F������ͻ�������������ʼ�ղ��䣬���������ܶȱ��ֲ��䣬��ȷ����ƽ��״̬����F����ΪAE��
��4��A�������¶�ƽ�������ƶ�����������߰��IJ��ʣ���A����B������ѹǿ��ƽ�������ƶ�����������߰��IJ��ʣ���B��ȷ��C��ʹ�ô������ı䷴Ӧ���ʣ�����Ӱ��ƽ���ƶ������ı䰱�IJ��ʣ���C����D.����Һ������ϵ�з��������������ƽ�������ƶ�����������߰��IJ��ʣ���D��ȷ����ΪBD��
��5�� 2NH3 (g) +CO2(g) ![]() CO (NH2)2 (1)+H2O (g)
CO (NH2)2 (1)+H2O (g)
��ʼ���ʵ���Ũ�ȣ�mol/L�� 1 0.5 0 0
�仯���ʵ���Ũ�ȣ�mol/L�� 0.5 0.25 0 0.25
ƽ�����ʵ���Ũ�ȣ�mol/L�� 0.5 0.25 0 0.25
��100��ʱ��Ӧ��ƽ�ⳣ��K=![]() =
=![]() =4��
=4��
��ͼʾ��֪�ں��������£�ѹǿԽ��CO2��ת����Խ��P1��P2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ�����������Ϊԭ��������������Ķ�����Ԫ�ء��ס�������ͬһ���壬���������촦��ͬһ���ڣ���ԭ�ӵ������������Ǽס��ҡ���ԭ������������֮�͡��ס�����ɵij�������X��ʹʪ��ĺ�ɫʯ����ֽ��������ĵ�����X��Ӧ�������ҵĵ��ʣ�ͬʱ������������ˮ�������ԵĻ�����Y��Z,0.1 mol/L��Y��ҺpH>1�����ĵ��ʼ������Ԫ������������ˮ�������Һ��Ӧ������L��Ҳ����Z��ˮ��Һ��Ӧ�����Σ����������ɻ�����M��
��ش��������⣺
(1)�����ӵĽṹʾ��ͼΪ________��
(2)��ĵ�����X��Ӧ���ɵ�Y��Z�����ʵ���֮��Ϊ2��4����Ӧ�б������������뱻��ԭ�����ʵ����ʵ���֮��Ϊ________��
(3)д������Z��ϡ��Һ�������L��ϡ��Һ�з�����Ӧ�����ӷ���ʽ��__________________��
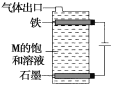
(4)����ͼ���M�ı�����Һ��д���õ����з�����Ӧ���ܷ�Ӧ����ʽ��____________________________������ֵ���������Һ��μ����̪��Һ�У��۲쵽��������____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����µ��뷽��ʽ�������( )
A��MgCl2��Mg2++2Cl�� B��Fe2(SO4)3��2Fe3++3SO42��
C��NaHCO3��Na++H++CO32�� D��NaOH��Na++OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1L���ܱ������У�����3A(g)+B(g)2C(g)�ķ�Ӧ�����������A��B����4mol��1min�ڣ������(A)=1.2mol��L��1��min��1�����ʱ������B�����ʵ�����
A. 1.6mol B. 2.8mol C. 3.2mol D. 3.6mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼ�ŵ�þ�������������в��ܼ���ȼ�յ��ǣ� ��
A��CO2 B��N2 C��Cl2 D��He
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£������Ϊ2L���ܱ�������ͨ������M��N��������Ӧ�����ʵ�����ʱ��ı仯��ϵ��ͼ������˵����ȷ����( )
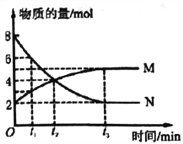
A. M��N֮��ת���ķ�Ӧ����ʽΪM =2N
B. t2ʱ�̣���Ӧ�ﵽƽ�⣬�����淴Ӧ���ʴﵽ���
C. t3ʱ�̣�M�ķ�Ӧ����Ϊ![]() mol��L-1��min-l
mol��L-1��min-l
D. t1ʱ�̣�������������M��N�����ʵ���Ũ��֮��Ϊ1:2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼת����ϵ�У�A��B��G��Y��������Ԫ����ɵĵ��ʣ�������ǻ����ͨ��������B��E��F��Y��Ϊ���壻A��C��H��ɫ��Ӧ���ʻ�ɫ��E��F������������̡�

�밴Ҫ��ش��������⣺
��1��������F�ĵ���ʽ_______________��
��2�����Ϸ�Ӧ�����ڻ���������������ԭ��Ӧ����________________���Ӧ��ţ���
��3��E��F��Ӧ�Ļ�ѧ����ʽΪ________________________________________��
����������C��D����Һ��Ӧ�����ӷ�Ӧ����ʽΪ_______________________��
��4��G��C����Һ������Ӧ�����ӷ���ʽΪ_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)����������������������ʻ���������������������̱���
�� �������ڸ��ϲ��ϵ���________(����ĸ)��
a. ��ͭ������������b. �����֡�����������c. ���
�� �������������ʹ�������ֺϽ𣬺Ͻ�ͨ�������е�������________(����ĸ)��
a. �۵�� b. Ӳ�ȴ� c. ��ʴ
�� Ϊ��ֹ����������ʴ�����оٴ벻��������________(����ĸ)��
a. �����п b. ʹ�ò���� c. ���渽��ͭƬ
(2)�˵ijɳ���������ҪʳƷ��ҩ���ѧԪ�صȡ�
�� ���ξ��кܸߵ�Ӫ����ֵ��ҩ�ü�ֵ�����е����ʡ���֬�������ᡢ����ά���غͷḻ�ĸơ��ס�����Ԫ�أ�������������������Ԫ�ص���________����֬�����������յ�ˮ�����Ϊ��֬�����________��
�� ά����C�ܷ��λ�Ѫ�������л�ԭ�ԣ���֤ά����C���л�ԭ�Կ���ʹ�õ�����Һ��________(������ˮ�������⻯����Һ��)��
�� �������θ����࣬��ʹ����е����ʣ���ʱӦ���������˫�ǻ�������[NaAl(OH)2CO3]����һ�ֳ��õ������������θ�ᷢ����Ӧ�Ļ�ѧ����ʽΪ
____________________��
(3)���ǵ������뻷��������ء�
�� ��Ȼˮ�к���ϸС�����������������������________(��һ�����ʵĻ�ѧʽ)��Ϊ����������������
�� �Ͼɵ�ش������������____________��Ⱦ��������ˮ�еĸ����ʿ��ó����������磺����Ǧ(Pb2��)��ˮ�м���Na2SʹPb2��ת��Ϊ________(�ѧʽ)��������ȥ��
�� ijЩװ���õľ�������װ����ϻ����ͷų�������Ⱦ��Ũ�ȹ��ߣ�Ӱ�����彡����������Ⱦ����Ҫ��____________(�ѧʽ)���̵����к���Ũ�Ƚϸߵ�SO2������ʯ���������ռ���SO2����ת������______________(�ѧʽ)��
�� �ö�����̼����������Ʒ�������ڶ�����̼�Ĵ������ա�CO2��H2�ڴ����������¿��Ժϳ��Ҵ����÷�Ӧ�Ļ�ѧ����ʽΪ____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������֤�����淴ӦN2��3H2![]() 2NH3�Ѵﵽƽ��״̬����
2NH3�Ѵﵽƽ��״̬����
��һ��N��N�����ѵ�ͬʱ����6��N��H������
��v(H2)��0.6 mol��L��1��min��1��v(NH3)��0.4 mol��L��1��min��1
������������������ʱ����ϵѹǿ���ٸı�
��NH3��N2��H2��������������ٸı�
�����º���ʱ����������������ֲ���
A. �ڢۢ� B. �٢ۢ� C. �٢ڢ� D. �ۢܢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com