
【题目】已知漂白粉有效成分能与浓盐酸反应生成Cl2和一种固体时能作干燥剂的物质等。请从图中选用适当的实验装置,设计一个最简单的实验,测定漂白粉有效成分的质量分数。


请填写下列空白:
(1)实验中漂白粉有效成分与浓盐酸反应的化学方程式为_______________________。
(2)所选用装置的连接顺序应是(填各接口的字母代号)_______________。
(3)在读取量筒的刻度数时,应注意________________________________________________。
(4)若各仪器内仍残留有少量Cl2,则测定结果将___(填“偏高”、“偏低”或“不影响”),其原因是____。
(5)某同学在实验中发现量筒里未收集到液体,其失败的原因可能是下列中的________。
①装置漏气 ②浓盐酸已变成稀盐酸 ③所选仪器容积太大 ④漂白粉已全变质 ⑤e接f ⑥d接f
A.①②③ B.①②④⑤ C.①②③⑥ D.全部
【答案】Ca(ClO)2+4HCl===CaCl2+2Cl2↑+2H2O a接e,d接f C、D两仪器内的液面应相平;视线与凹液面最低点应相平;装置内气体应恢复至室温 不影响 同温同压下,同量的Cl2和空气所排出的液体体积相等 B
【解析】
(1)漂白粉的有效成分为次氯酸钙,可与盐酸发生氧化还原反应生成氯气和氯化钙。
(2)实验生成氯气,可用排饱和食盐水法测定生成氯气的体积,可确定次氯酸钙的含量。
(3)在读取量筒的刻度数时,注意气体的压强以及避免眼睛视线问题。
(4)氯气排除空气,残留氯气和排除的空气体积相等。
(5)如没有收集到氯气,可能是漂白粉变质或装置漏气、装置连接错误等。
(1)漂白粉的有效成分为次氯酸钙,可与盐酸发生氧化还原反应生成氯气和氯化钙,反应的方程式为Ca(ClO)2+4HCl===CaCl2+2Cl2↑+2H2O ;正确答案: Ca(ClO)2+4HCl===CaCl2+2Cl2↑+2H2O 。
(2)实验生成氯气,可用排饱和食盐水法测定生成氯气的体积,可确定次氯酸钙的含量,连接顺序为a接e,d接f;正确答案:a接e,d接f。
(3)读数时,为避免误差,首先应使C、D两仪器内的压强相等,则液面应齐平;视线与凹液面最低点应齐平,且在室温下读数;正确答案 (1)C、D两仪器内的液面应齐平;(2)视线与凹液面最低点应齐平;(3)装置内气体应恢复至室温;正确答案:C、D两仪器内的液面应相平;视线与凹液面最低点应相平;装置内气体应恢复至室温。
(4)氯气排除空气, 同温同压下,同量的氯气和空气所排出的液体体积相等;正确答案:不影响;同温同压下,同量的Cl2和空气所排出的液体体积相等。
(5)如没有收集到氯气,可能是漂白粉变质或装置漏气、装置连接错误等,如为稀盐酸,与次氯酸钙也不反应, ①②④⑤符合;正确答案: B。


科目:高中化学 来源: 题型:
【题目】下列离子方程式中,属于水解反应的是
A. CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
B. CO2+H2O![]() HCO3-+H+
HCO3-+H+
C. HCOOH+H2O![]() HCOO-+H3O+
HCOO-+H3O+
D. HS-+H2O![]() S2-+H3O+
S2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲元素的原子序数是19,乙元素原子核外有两个电子层,最外电子层上有6个电子;丙是元素周期表第ⅠA族中金属性最弱的碱金属元素。由此推断:
(1)甲元素在周期表中位于第_______周期;乙元素在周期表中位于第______族;丙元素的名称为________。
(2)甲的单质与水反应的离子方程式为____________________________,乙单质与丙单质反应的化学方程式为____________________________________,甲的单质与水反应的生成物的电子式为:_______________,___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,改变0.1mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数![]() (X)随pH的变化如图所示[已知
(X)随pH的变化如图所示[已知![]() (X) =
(X) =![]() ]。下列叙述错误的是( )
]。下列叙述错误的是( )

A. pH=1.2时,c(K+)+c(H+)=c(H2A)+c(OH-)
B. 常温下,H2A的电离平衡常数Ka2=10-42
C. pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D. KHA溶液中离子浓度为c(K+)>c(HA-)>c(OH-)>c(H2A)>c(H+)>c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 蔗糖、淀粉、油脂及其水解产物均为非电解质
B. 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
C. 用新制Cu(OH)2悬浊液可以鉴别乙酸、乙醇和葡萄糖
D. 分子![]() 所有碳原子一定不能共平面
所有碳原子一定不能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如下:

下列说法正确的是
A. 图示显示:起始时的2个H2O最终都参与了反应
B. 过程Ⅰ、过程Ⅱ均为放热过程
C. 过程Ⅲ只生成了极性共价键
D. 使用催化剂降低了水煤气变换反应的ΔH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下:
下列说法不正确的是

A. CO和O生成CO2是放热反应。
B. 在该过程中,CO分子中碳氧键没有断裂成C和O。
C. 在该过程中,O与CO中C结合形成共价键。
D. 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Fe3+ +Ag ![]() Fe2+ +Ag+ (K=1.8)设计成下图所示原电池(盐桥中装有琼脂——KNO3溶液)。在本题中灵敏电流计指针偏转方向即电子流动方向。
Fe2+ +Ag+ (K=1.8)设计成下图所示原电池(盐桥中装有琼脂——KNO3溶液)。在本题中灵敏电流计指针偏转方向即电子流动方向。
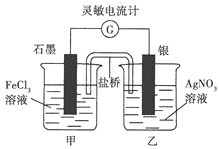
开始接通导线时灵敏电流计指针向左偏转,一段时间后电流计指针指向中间“0”刻度。然后进行如下实验:
(1)向A烧杯中滴加浓FeCl3溶液,指针___(填“向左”、“向右”或“不偏转”);
(2)向B烧杯中滴加少量Na2S溶液,指针__(填“向左”、“向右”或“不偏转”),原因为___。
(3)下图所示原电池的负极是_____,负极的电极反应式是____________,写出该反应的离子方程式________________________,该反应的平衡常数等于____________。(Ksp(AgCl)=1.8×10-10)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com