
【题目】下列说法正确的是( )
A. 蔗糖、淀粉、油脂及其水解产物均为非电解质
B. 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
C. 用新制Cu(OH)2悬浊液可以鉴别乙酸、乙醇和葡萄糖
D. 分子![]() 所有碳原子一定不能共平面
所有碳原子一定不能共平面
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】下列图象与对应实验完全吻合的是:
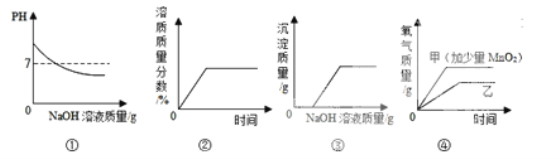
A.①往一定量的盐酸中滴加NaOH溶液至过量
B.②将一定量的不饱和KNO3溶液恒温蒸发水
C.③向一定量CuSO4溶液和稀硫酸的混合溶液中滴加NaOH溶液
D.④用两份等质量等溶质质量分数的过氧化氢溶液制取氧气(甲加少量MnO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳呼吸电池”是一种新型能源装置,其工作原理如下图。下列说法正确的是

A. 该装置是将电能转变为化学能
B. 正极的电极反应为:C2O42--2e-=2CO2
C. 每得到1 mol草酸铝,电路中转移3 mol电子
D. 利用该技术可捕捉大气中的CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx是造成大气污染的主要物质,用还原法将其转化为无污染的物质,对于消除环境污染有重要意义。
(1)已知:2C(s)+O2(g)![]() 2CO(g) △H1= -221.0 kJ/mol
2CO(g) △H1= -221.0 kJ/mol
N2(g)+O2(g)![]() 2NO (g) △H2= +180.5 kJ/mol
2NO (g) △H2= +180.5 kJ/mol
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H3= -746.0 kJ/mol
2CO2(g)+N2(g) △H3= -746.0 kJ/mol
回答下列问题:
①用焦炭还原NO生成无污染气体的热化学方程式为_______。
②在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mol/L)随时间(s)的变化如下表。
已知:三个容器的反应温度分别为T甲= 400℃、T乙= 400℃、T丙= a ℃
时间 | 0 s | 10 s | 20 s | 30 s | 40 s |
甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
丙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
甲容器中,该反应的平衡常数K=_______。丙容器的反应温度a _______400℃(填“”、“<”或“=”),理由是_______。
(2)用NH3催化还原NOx消除氮氧化物的污染。
已知:8NH3(g)+6NO2(g)![]() 7N2(g) +12H2O(l) △H<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。
7N2(g) +12H2O(l) △H<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。

①在催化剂A的作用下,0~4 min的v(NH3) = _______。
②该反应活化能Ea(A)、Ea(B)、Ea(C)由大到小的顺序是_______,理由是_______。
③下列说法正确的是_______(填标号)。
a.使用催化剂A达平衡时,△H值更大
b.升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HCN、CN在溶液中存在下列平衡,对应的平衡常数分别为K1和K2.①HCNH++CN△H1>0 K1 ②CN+H2OHCN+OH△H2>0 K2,常温下(K1=6.2×1010),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述不正确的是( )
A. K2≈1.6×103 B. 2c(Na+)=c(HCN)+c(CN-)
C. 混合溶液的pH>7 D. 对混合溶液升温, K1增大、K2增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知漂白粉有效成分能与浓盐酸反应生成Cl2和一种固体时能作干燥剂的物质等。请从图中选用适当的实验装置,设计一个最简单的实验,测定漂白粉有效成分的质量分数。


请填写下列空白:
(1)实验中漂白粉有效成分与浓盐酸反应的化学方程式为_______________________。
(2)所选用装置的连接顺序应是(填各接口的字母代号)_______________。
(3)在读取量筒的刻度数时,应注意________________________________________________。
(4)若各仪器内仍残留有少量Cl2,则测定结果将___(填“偏高”、“偏低”或“不影响”),其原因是____。
(5)某同学在实验中发现量筒里未收集到液体,其失败的原因可能是下列中的________。
①装置漏气 ②浓盐酸已变成稀盐酸 ③所选仪器容积太大 ④漂白粉已全变质 ⑤e接f ⑥d接f
A.①②③ B.①②④⑤ C.①②③⑥ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两位同学设计实验确定某酸HA是弱电解质,实验方案如下:

甲:取纯度相同,质量、大小相等的锌粒于两支试管中,同时加入浓度均为0.1 mol·L-1 的HA溶液、稀盐酸各10 mL,按图装好,观察现象。
乙:方案一:用pH计测定浓度为 0.1 mol·L-1HA溶液的pH;
方案二:取pH=3的HA溶液5 mL稀释至500 mL,再用pH计测其pH。
回答下列问题:
(1)甲同学设计的方案中,说明HA是弱电解质的实验现象是___________ (填序号)。
A. 加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
B. 加入HA溶液后,试管上方的气球鼓起慢
C. 加入稀盐酸后,试管上方的气球鼓起慢
(2)乙同学设计的方案一中说明HA是弱电解质的理由是:__________________
(3)乙同学设计的方案二中说明HA是弱电解质的pH的范围为__________________
(4)丙同学为了进一步证明外界条件对弱电解质电离平衡移动的情况,设计如下实验:
①使HA的电离程度和c(H+)都减小,c(A-)增大,可在 0.1mol·L-1 的HA溶液中,选择加入____________试剂;
②使HA的电离程度减小,c(H+)和c(A-)都增大,可在 0.1mol·L-1 的HA溶液中,选择加入_____________试剂。
(5)若从盐类水解原理角度设计一个合理而比较容易进行的方案(药品可任取) ,证明HA是弱电解质,你的设计方案是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料是人类文明进步的阶梯,第ⅢA、ⅣA、VA及Ⅷ族元素是组成特殊材料的重要元素。
回答下列问题:
(1)基态B核外电子占据的最高能级的电子云轮廓图形状为________。与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为______。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态氮原子的未成对电子数相同,则其基态原子的价层电子排布式为_____。
(3)经测定发现,N2O5固体由NO2+和NO3-两种离子组成,该固体中N原子杂化类型有__。
(4)MgCO3的热分解温度_____(填“高于”或“低于”)CaCO3的原因是________。
(5)NH3分子在独立存在时H-N-H键角为107°。如图是[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释NH3形成如图配合物后H-N-H键角变大的原因:_________。
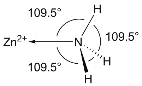
(6)某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中位置如图所示,其堆积方式为_____,Li+占据阴离子组成的所有正四面体中心,该化合物的化学式为_____(用最简整数比表示)。假设晶胞边长为anm,NA代表阿伏伽德罗常数的值,则该晶胞的密度为_____g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1mol/L的二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示![]() 。下列叙述正确的是
。下列叙述正确的是

A. Ka2(H2A)的数量级为10- 4
B. 0.1mol/L的NaHA溶液,pH=2.7
C. 向pH=0.5的溶液中逐滴加入强碱至pH=2.7的过程中,每滴一滴强碱,在X点时溶液pH变化最大
D. 0.1mol/LNa2A溶液的pH=8.6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com