
【题目】下列图象与对应实验完全吻合的是:
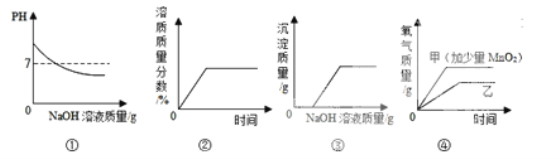
A.①往一定量的盐酸中滴加NaOH溶液至过量
B.②将一定量的不饱和KNO3溶液恒温蒸发水
C.③向一定量CuSO4溶液和稀硫酸的混合溶液中滴加NaOH溶液
D.④用两份等质量等溶质质量分数的过氧化氢溶液制取氧气(甲加少量MnO2)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】0.1 mol·L-1的氨水10mL,加蒸馏水稀释到1L后,下列变化中正确的是( )
①NH3·H2O电离程度增大 ②c(NH3·H2O)增大 ③NH4+数目增多 ④c(OH-)增大
⑤溶液导电能力增强 ⑥![]() 增大
增大
A. ①⑤⑥ B. ②③④ C. ①③⑥ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是( )
A. 加入有色布条,一会儿有色布条退色,说明有Cl2存在
B. 溶液呈黄绿色,且有刺激性气味,说明有HClO分子存在
C. 先加入硝酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
![]()
其中第①步中存在平衡:2CrO42- (黄色)+2H+![]() Cr2O72- (橙色)+H2O。下列有关说法正确的是( )
Cr2O72- (橙色)+H2O。下列有关说法正确的是( )
A. 对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成
B. 第①步当2v(Cr2O72-)=v(CrO42-)时,达到了平衡状态
C. 第②步中,还原0.1 mol Cr2O72-需要91.2 g FeSO4
D. 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其相关性质。
(1)若向装有饱和FeCl3溶液的烧杯中分别滴入下列物质中,能形成胶体的是_______(填序号)。
a.冷水 b.沸水 c.NaOH浓溶液 d.NaCl浓溶液
(2)写出制备Fe(OH)3胶体的化学方程式:_____________________
(3)用激光笔照射装有Fe(OH)3胶体的烧杯,能在侧面看到一条_________,这种现象称为丁达尔效应
(4)Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是________(填序号)。
a.分散质粒子大小不同 b.颜色不同 c.后者不稳定
(5)若向制得的胶体中再加入稀HCl,红褐色分散系会被破坏,变为黄色溶液,写出相关离子方程式 ____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,属于水解反应的是
A. CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
B. CO2+H2O![]() HCO3-+H+
HCO3-+H+
C. HCOOH+H2O![]() HCOO-+H3O+
HCOO-+H3O+
D. HS-+H2O![]() S2-+H3O+
S2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表中有些元素有“隔类相似”现象(即对角线相似),如Mg与Li;Si和B;Be和Al等,现用熔融LiCl电解可得锂和氯气,若用已潮解的LiCl加热蒸干并强热至熔融,再用惰性电
极电解。结果得到金属锂和一种无色无味气体,其主要理由是( )
A. 电解出的锂和水反应放出氢气
B. 电解前LiCl在加热时水解
C. 电解时产生的无色气体是氯气
D. 在高温时阳极放出氯气与水作用释氧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】湿法炼锌厂在除杂过程中会产生大量铁矾渣。某黄钾铁矾渣主要含有K2Fe6(SO4)4(OH)12、ZnO·Fe2O3及少量CaO、MgO、SiO2等。一种由黄钾铁矾渣制备复合镍锌铁氧体( NiZnFe4O8)的流程如下:

回答下列问题
(1)滤渣I的主要成分是___________。
(2)净化除杂阶段加入Fe粉时发生反应的离子方程式为___________、___________。已知:25℃时Ksp(CaF2)=2.7×10-11, Ksp (MgF2)=6.4×10-19。加入NH4F使Ca2+、Mg2+离子沉淀,若沉淀后溶液中c(Ca2+)=2.7×10-6mol·L-1,则c(Mg2+)=___________ mol·L-1。
(3)在Fe2+、Ni2+、Zn2+共沉淀过程中,三种离子的损失浓度与pH的关系曲线如图所示,pH与n(NH4HCO3)︰n(Fe2++Ni2++Zn2+)的关系曲线如图所示。为提高原料利用率,n( NH4HCO3)︰n(Fe2++Ni2++Zn2+)最好控制在___________左右;按此比例,若以Me代表Fe、Ni、Zn元素,则生成MeCO3·2Me(OH)2·H2O沉淀的化学反应方程式为___________。

(4)铁氧体工艺阶段制备 NiZnFe4O8过程中,需加入___________剂(填“氧化”或“还原”)。按照上述流程,一座10万吨规模的锌厂每年产生黄钾铁矾渣约5万吨,Fe3+含量为27%,理论上每年可制备复合镍锌铁氧体(NiZnFe4O8,M=476g·mol-1)___________万吨(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 蔗糖、淀粉、油脂及其水解产物均为非电解质
B. 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
C. 用新制Cu(OH)2悬浊液可以鉴别乙酸、乙醇和葡萄糖
D. 分子![]() 所有碳原子一定不能共平面
所有碳原子一定不能共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com