
【题目】湿法炼锌厂在除杂过程中会产生大量铁矾渣。某黄钾铁矾渣主要含有K2Fe6(SO4)4(OH)12、ZnO·Fe2O3及少量CaO、MgO、SiO2等。一种由黄钾铁矾渣制备复合镍锌铁氧体( NiZnFe4O8)的流程如下:

回答下列问题
(1)滤渣I的主要成分是___________。
(2)净化除杂阶段加入Fe粉时发生反应的离子方程式为___________、___________。已知:25℃时Ksp(CaF2)=2.7×10-11, Ksp (MgF2)=6.4×10-19。加入NH4F使Ca2+、Mg2+离子沉淀,若沉淀后溶液中c(Ca2+)=2.7×10-6mol·L-1,则c(Mg2+)=___________ mol·L-1。
(3)在Fe2+、Ni2+、Zn2+共沉淀过程中,三种离子的损失浓度与pH的关系曲线如图所示,pH与n(NH4HCO3)︰n(Fe2++Ni2++Zn2+)的关系曲线如图所示。为提高原料利用率,n( NH4HCO3)︰n(Fe2++Ni2++Zn2+)最好控制在___________左右;按此比例,若以Me代表Fe、Ni、Zn元素,则生成MeCO3·2Me(OH)2·H2O沉淀的化学反应方程式为___________。

(4)铁氧体工艺阶段制备 NiZnFe4O8过程中,需加入___________剂(填“氧化”或“还原”)。按照上述流程,一座10万吨规模的锌厂每年产生黄钾铁矾渣约5万吨,Fe3+含量为27%,理论上每年可制备复合镍锌铁氧体(NiZnFe4O8,M=476g·mol-1)___________万吨(保留两位有效数字)
【答案】SiO2 2Fe3+ + Fe = 3Fe2+ Fe + 2H+ =Fe2+ + H2↑ 6.4×10-14 2.0 3MeSO4+6NH4HCO3=MeCO3·2Me(OH)2·2H2O↓+3(NH4)2SO4+5CO2↑ 氧化 4.3
【解析】
(1)SiO2不和硫酸反应,因而滤渣Ⅰ为SiO2。
(2)净化除杂阶段加入Fe粉与过量的稀硫酸置换出氢气,与Fe3+发生氧化还原反应,因而离子方程式为2Fe3+ + Fe = 3Fe2+ ,Fe + 2H+ =Fe2+ + H2↑。Ksp(CaF2)=c(Ca2+)c2(F-),带入数据,根据溶液中的钙离子浓度可以求出c(F-)=10-2.5mol/L,再根据Ksp(MgF2)=c(Mg2+)c2(F-),解得c(Mg2+)=6.4×10-14mol/L。
(3)观察图1可知pH=7.2时,三种离子的损失浓度最大,即沉淀达到最大值,因而此时的pH值最合理,结合图2,当pH等于7.2时,n( NH4HCO3)︰n(Fe2++Ni2++Zn2+)等于2.0,说明n( NH4HCO3)︰n(Fe2++Ni2++Zn2+)最好控制在2.0左右。根据滤液Ⅱ配料,可知阴离子还有SO42-,因而反应物为MeSO4和NH4HCO3,Me2+和HCO3-要发生双水解,除了信息给的沉淀,产物还有CO2和(NH4)2SO4,因而化学方程式为3MeSO4+6NH4HCO3=MeCO3·2Me(OH)2·2H2O↓+3(NH4)2SO4+5CO2↑。
(4)流程前期操作得到的是Fe2+,而铁氧体工艺阶段得到的 NiZnFe4O8铁元素是+3价,说明需要加入氧化剂。因2Fe3+ + Fe = 3Fe2+,说明3n(Fe3+)=2n(Fe2+),可知3m(Fe3+)=2m(Fe2+),所以流程中共加入铁元素的质量为5×0.27×3/2=2.025万吨,而NiZnFe4O8铁元素质量分数为56×4/476=47%,因而NiZnFe4O8的质量为2.025÷47%=4.3万吨。


科目:高中化学 来源: 题型:
【题目】在298 K时,实验测得溶液中的反应:H2O2+2HI===2H2O+I2,在不同浓度时的化学反应速率见下表,由此可推知当c(HI)=0.500 mol·L-1,c(H2O2)=0.400 mol·L-1时的反应速率为( )
实验编号 | 1 | 2 | 3 | 4 | 5 |
c(HI)/mol·L-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
c(H2O2)/mol·L-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
v/mol·L-1·s-1 | 0.007 60 | 0.015 3 | 0.022 7 | 0.015 1 | 0.022 8 |
A. 0.152 mol·L-1·s-1 B. 0.038 0 mol·L-1·s-1
C. 0.608 mol·L-1·s-1 D. 0.760 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象与对应实验完全吻合的是:
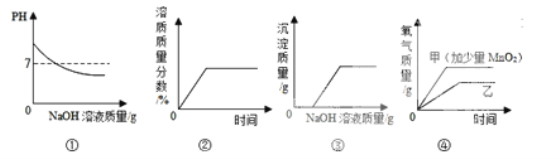
A.①往一定量的盐酸中滴加NaOH溶液至过量
B.②将一定量的不饱和KNO3溶液恒温蒸发水
C.③向一定量CuSO4溶液和稀硫酸的混合溶液中滴加NaOH溶液
D.④用两份等质量等溶质质量分数的过氧化氢溶液制取氧气(甲加少量MnO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁电池作为一种低成本、高安全的储能装置,正受到国内外广大科研人员的关注。一种以固态含Mg2+的化合物为电解质的镁电池的总反应如下。下列说法错误的是
xMg+V2O5 ![]() MgxV2O5
MgxV2O5
A. 充电时,阳极质量减小
B. 充电时,阴极反应式:Mg2++2e-=Mg
C. 放电时,正极反应式为:V2O5+xMg2++2xe-=MgxV2O5
D. 放电时,电路中每流过2mol电子,固体电解质中有2molMg2+迁移至正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,电池示意如图所示:

①____极(填a或b)为电池的正极,电池工作时电子的流向为_______(填a→b或b→a)
②写出该电池负极的电极反应式________________________________________
(2)图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。

①Y中总反应的化学方程式为_____________________,滤纸上c点附近会变________色。
②电解一段时间后,Z产生280 mL的气体(标准状况下),此时溶液的体积为500 mL,假设溶液中还有AgNO3存在,则Z中溶液的pH是________,需加入________g的________可使溶液复原。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 常温下,0.5 mol·L-1Fe2(SO4)3溶液中含Fe3+数目为1 NA
B. 1mol Na2CO3晶体中含CO32- 离子数小于1NA
C. 常温常压下,16g O2和O3混合气体中,含氧原子的总数为1NA
D. 5.6g Fe与足量稀盐酸反应,转移电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳呼吸电池”是一种新型能源装置,其工作原理如下图。下列说法正确的是

A. 该装置是将电能转变为化学能
B. 正极的电极反应为:C2O42--2e-=2CO2
C. 每得到1 mol草酸铝,电路中转移3 mol电子
D. 利用该技术可捕捉大气中的CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx是造成大气污染的主要物质,用还原法将其转化为无污染的物质,对于消除环境污染有重要意义。
(1)已知:2C(s)+O2(g)![]() 2CO(g) △H1= -221.0 kJ/mol
2CO(g) △H1= -221.0 kJ/mol
N2(g)+O2(g)![]() 2NO (g) △H2= +180.5 kJ/mol
2NO (g) △H2= +180.5 kJ/mol
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H3= -746.0 kJ/mol
2CO2(g)+N2(g) △H3= -746.0 kJ/mol
回答下列问题:
①用焦炭还原NO生成无污染气体的热化学方程式为_______。
②在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mol/L)随时间(s)的变化如下表。
已知:三个容器的反应温度分别为T甲= 400℃、T乙= 400℃、T丙= a ℃
时间 | 0 s | 10 s | 20 s | 30 s | 40 s |
甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
丙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
甲容器中,该反应的平衡常数K=_______。丙容器的反应温度a _______400℃(填“”、“<”或“=”),理由是_______。
(2)用NH3催化还原NOx消除氮氧化物的污染。
已知:8NH3(g)+6NO2(g)![]() 7N2(g) +12H2O(l) △H<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。
7N2(g) +12H2O(l) △H<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。

①在催化剂A的作用下,0~4 min的v(NH3) = _______。
②该反应活化能Ea(A)、Ea(B)、Ea(C)由大到小的顺序是_______,理由是_______。
③下列说法正确的是_______(填标号)。
a.使用催化剂A达平衡时,△H值更大
b.升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料是人类文明进步的阶梯,第ⅢA、ⅣA、VA及Ⅷ族元素是组成特殊材料的重要元素。
回答下列问题:
(1)基态B核外电子占据的最高能级的电子云轮廓图形状为________。与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为______。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态氮原子的未成对电子数相同,则其基态原子的价层电子排布式为_____。
(3)经测定发现,N2O5固体由NO2+和NO3-两种离子组成,该固体中N原子杂化类型有__。
(4)MgCO3的热分解温度_____(填“高于”或“低于”)CaCO3的原因是________。
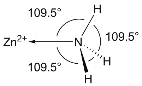
(5)NH3分子在独立存在时H-N-H键角为107°。如图是[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释NH3形成如图配合物后H-N-H键角变大的原因:_________。
(6)某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中位置如图所示,其堆积方式为_____,Li+占据阴离子组成的所有正四面体中心,该化合物的化学式为_____(用最简整数比表示)。假设晶胞边长为anm,NA代表阿伏伽德罗常数的值,则该晶胞的密度为_____g/cm3。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com