
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
![]()
其中第①步中存在平衡:2CrO42- (黄色)+2H+![]() Cr2O72- (橙色)+H2O。下列有关说法正确的是( )
Cr2O72- (橙色)+H2O。下列有关说法正确的是( )
A. 对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成
B. 第①步当2v(Cr2O72-)=v(CrO42-)时,达到了平衡状态
C. 第②步中,还原0.1 mol Cr2O72-需要91.2 g FeSO4
D. 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至9
【答案】C
【解析】
A.加入适量稀硫酸后,氢离子浓度增大,平衡右移,溶液变橙色,有利于Cr2O72-的生成,故A错误。
B.2υ(Cr2O72-)=υ(CrO42-)没有指明是正反应速率还是逆反应速率,它们相等不能判断达到平衡,故B错误。
C.Cr2O72-被还原成Cr3+,1 mol Cr2O72-得到6 mol电子,需要6 mol FeSO4,故还原0.1 mol Cr2O72-需要91.2 g FeSO4,故C正确。
D.Cr(OH)3的溶度积Ksp=10-32= c3(OH-)c(Cr3+),当c(Cr3+)降至10-5 mol/L,c(OH-)=10-9 mol/L,pH=5,故D错误。本题选C。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】在298 K时,实验测得溶液中的反应:H2O2+2HI===2H2O+I2,在不同浓度时的化学反应速率见下表,由此可推知当c(HI)=0.500 mol·L-1,c(H2O2)=0.400 mol·L-1时的反应速率为( )
实验编号 | 1 | 2 | 3 | 4 | 5 |
c(HI)/mol·L-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
c(H2O2)/mol·L-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
v/mol·L-1·s-1 | 0.007 60 | 0.015 3 | 0.022 7 | 0.015 1 | 0.022 8 |
A. 0.152 mol·L-1·s-1 B. 0.038 0 mol·L-1·s-1
C. 0.608 mol·L-1·s-1 D. 0.760 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+C(g)===D(g);ΔH=-Q1kJ/mol,B(g)+C(g)===E(g);ΔH=-Q2kJ/mol,Q1、Q2均大于0,且Q1>Q2,若A与B组成的混合气体 1mol与足量的C反应,放热为Q3kJ,则原混合气体中A与B物质的量之比为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数约为 6.02×1023 mol1,下列叙述中正确的是( )
A. 常温常压下,18.0 g 重水(D2O)所含的电子数约为 10×6.02×1023 个
B. 一定条件下,46.0 g 二氧化氮和四氧化二氮的混合气体中含有的氮原子数约为 6.02×1023 个
C. 已知:CO(g) +2H2(g)![]() CH3OH(g) ΔH=-91 kJ·mol-1 ,一定条件下若加入 6.02×1023个CO和2×6.02×1023个H2,则放出91 kJ的热量
CH3OH(g) ΔH=-91 kJ·mol-1 ,一定条件下若加入 6.02×1023个CO和2×6.02×1023个H2,则放出91 kJ的热量
D. 1.0 L 1.0mol·L1 CH3COOH溶液中,CH3COOH分子数约为6.02×1023 个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚磷酸(H3PO3)是具有强还原性的弱酸,可以被银离子氧化为磷酸。1摩尔亚磷酸最多消耗2摩尔氢氧化钠。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式__________。
(2)Na2HPO3是____(填“正盐”或“酸式盐”) 。
(3)亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为______________。
(4)某温度下,0.10 molL-1的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2 molL-1,该温度下H3PO3的电离平衡常数K1=___________________;(结果保留两位有效数字)。
(5)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)_____c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”,下同);在NaH2PO3溶液中,c(H+)+c(H3PO3)_____c(HPO32-)+c(OH-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象与对应实验完全吻合的是:
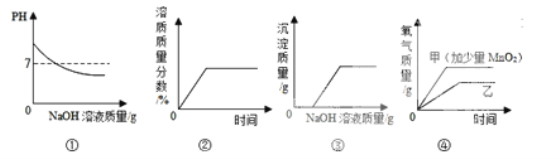
A.①往一定量的盐酸中滴加NaOH溶液至过量
B.②将一定量的不饱和KNO3溶液恒温蒸发水
C.③向一定量CuSO4溶液和稀硫酸的混合溶液中滴加NaOH溶液
D.④用两份等质量等溶质质量分数的过氧化氢溶液制取氧气(甲加少量MnO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁电池作为一种低成本、高安全的储能装置,正受到国内外广大科研人员的关注。一种以固态含Mg2+的化合物为电解质的镁电池的总反应如下。下列说法错误的是
xMg+V2O5 ![]() MgxV2O5
MgxV2O5
A. 充电时,阳极质量减小
B. 充电时,阴极反应式:Mg2++2e-=Mg
C. 放电时,正极反应式为:V2O5+xMg2++2xe-=MgxV2O5
D. 放电时,电路中每流过2mol电子,固体电解质中有2molMg2+迁移至正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx是造成大气污染的主要物质,用还原法将其转化为无污染的物质,对于消除环境污染有重要意义。
(1)已知:2C(s)+O2(g)![]() 2CO(g) △H1= -221.0 kJ/mol
2CO(g) △H1= -221.0 kJ/mol
N2(g)+O2(g)![]() 2NO (g) △H2= +180.5 kJ/mol
2NO (g) △H2= +180.5 kJ/mol
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H3= -746.0 kJ/mol
2CO2(g)+N2(g) △H3= -746.0 kJ/mol
回答下列问题:
①用焦炭还原NO生成无污染气体的热化学方程式为_______。
②在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mol/L)随时间(s)的变化如下表。
已知:三个容器的反应温度分别为T甲= 400℃、T乙= 400℃、T丙= a ℃
时间 | 0 s | 10 s | 20 s | 30 s | 40 s |
甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
丙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
甲容器中,该反应的平衡常数K=_______。丙容器的反应温度a _______400℃(填“”、“<”或“=”),理由是_______。
(2)用NH3催化还原NOx消除氮氧化物的污染。
已知:8NH3(g)+6NO2(g)![]() 7N2(g) +12H2O(l) △H<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。
7N2(g) +12H2O(l) △H<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。

①在催化剂A的作用下,0~4 min的v(NH3) = _______。
②该反应活化能Ea(A)、Ea(B)、Ea(C)由大到小的顺序是_______,理由是_______。
③下列说法正确的是_______(填标号)。
a.使用催化剂A达平衡时,△H值更大
b.升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com