
����Ŀ�������£��ı�0.1mol��L-1��Ԫ����H2A��Һ��pH����Һ�е�H2A��HA-��A2-�����ʵ�������![]() (X)��pH�ı仯��ͼ��ʾ[��֪
(X)��pH�ı仯��ͼ��ʾ[��֪![]() (X) =
(X) =![]() ]�����������������( )
]�����������������( )

A. pH=1.2ʱ��c(K+)+c(H+)=c(H2A)+c(OH-)
B. �����£�H2A�ĵ���ƽ�ⳣ��Ka2=10-42
C. pH=2.7ʱ��c(HA-)��c(H2A)=c(A2-)
D. KHA��Һ������Ũ��Ϊc(K+)��c(HA-)��c(OH-)��c(H2A)��c(H+)��c(A2-)
���𰸡�D
��������
��ͼ���֪��pH=1.2ʱ��c��H2A��=c��HA-����pH=2.7ʱ��c��H2A��=c��A2-����pH=4.2ʱ��c��HA-��=c��A2-��������pH������c��H2A����С��c��HA-����������С��c��A2-��������ϵ���ƽ�ⳣ���Լ�������ݼ��㣬�ɸ���������Ƚ�Ũ�ȴ�С��
A���ͼ���֪��pH=1.2ʱ��c��H2A��=c��HA-����c(A2-)=0�������غ��ϵΪc��K+��+c��H+��=c��OH-��+ c��HA-������c��K+��+c��H+��=c��OH-��+ c��H2A������A��ȷ��
B���ͼ���֪��pH=4.2ʱ��c��H+��=10-4.2mol/L��c��HA-��=c��A2-����K2��H2A��=![]() =c��H+��=10-4.2����B��ȷ��
=c��H+��=10-4.2����B��ȷ��
C���ͼ���֪��pH=2.7ʱ��c��H2A��=c��A2-���������������ݿ�֪c��HA-����c��H2A��=c��A2-������C��ȷ��
D���ͼ���֪��KHA��Һ�����ԣ�˵����Һ��HA-�������ˮ�⣬��c��H+����c��OH-����c��A2-����c��H2A������D����
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������(H3PO3)�Ǿ���ǿ��ԭ�Ե����ᣬ���Ա�����������Ϊ���ᡣ1Ħ���������������2Ħ���������ơ�
��1����֪���������PCl3ˮ����ɣ���д����Ӧ�����ӷ���ʽ__________��
��2��Na2HPO3��____(����Ρ�����ʽ�Ρ�) ��
��3���������������ӷ�Ӧʱ�������뻹ԭ�������ʵ���֮��Ϊ______________��
��4��ij�¶��£�0.10 molL-1��H3PO3��Һ��pHΪ1.6����c(H+)=2.5��10-2 molL-1�����¶���H3PO3�ĵ���ƽ�ⳣ��K1=___________________��(���������λ��Ч����)��
��5����H3PO3��Һ�еμ�NaOH��Һ�����ԣ�������Һ�У�c(Na+)_____c(H2PO3-)+2c(HPO32-)(���������������=������ͬ)����NaH2PO3��Һ�У�c(H+)+c(H3PO3)_____c(HPO32-)+c(OH-)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A. �����£�0.5 mol��L��1Fe2(SO4)3��Һ�к�Fe3+��ĿΪ1 NA
B. 1mol Na2CO3�����к�CO32- ������С��1NA
C. ���³�ѹ�£�16g O2��O3��������У�����ԭ�ӵ�����Ϊ1NA
D. 5.6g Fe������ϡ���ᷴӦ��ת�Ƶ�����Ϊ0.3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��������������(![]() )�ķ�ӦΪ��2 CH2=CH2(g) +O2(g)
)�ķ�ӦΪ��2 CH2=CH2(g) +O2(g)![]() 2
2![]() (g) ��H=-106 kJ��mol-1���䷴Ӧ�������£���Ag+O2
(g) ��H=-106 kJ��mol-1���䷴Ӧ�������£���Ag+O2![]() AgO2����
AgO2����
��CH2=CH2+AgO2![]()
![]() +AgO����
+AgO����
��CH2=CH2+6AgO![]() 2CO2+2H2O+6Ag����
2CO2+2H2O+6Ag����
�����йظ÷�Ӧ��˵����ȷ����
A. ��Ӧ�Ļ�ܵ���106 kJ��mol-1
B. AgO2Ҳ�Ƿ�Ӧ�Ĵ���
C. ������ϩŨ��������������������������
D. ������0.7 mol��ϩ���뷴Ӧ���ɵõ�0.6 mol��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NOx����ɴ�����Ⱦ����Ҫ���ʣ��û�ԭ������ת��Ϊ����Ⱦ�����ʣ���������������Ⱦ����Ҫ���塣
��1����֪��2C(s)+O2(g)![]() 2CO(g) ��H1= -221.0 kJ/mol
2CO(g) ��H1= -221.0 kJ/mol
N2(g)+O2(g)![]() 2NO (g) ��H2= +180.5 kJ/mol
2NO (g) ��H2= +180.5 kJ/mol
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ��H3= -746.0 kJ/mol
2CO2(g)+N2(g) ��H3= -746.0 kJ/mol
�ش��������⣺
���ý�̿��ԭNO��������Ⱦ������Ȼ�ѧ����ʽΪ_______��
����һ���¶��£���ס��ҡ������������ܱ������м���һ������NO�������Ľ�̿����Ӧ�����в�ø�������c(NO)��mol/L����ʱ�䣨s���ı仯���±���
��֪�����������ķ�Ӧ�¶ȷֱ�ΪT��= 400�桢T��= 400�桢T��= a ��
ʱ�� | 0 s | 10 s | 20 s | 30 s | 40 s |
�� | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
�� | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
�� | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
�������У��÷�Ӧ��ƽ�ⳣ��K=_______���������ķ�Ӧ�¶�a _______400�棨�������<����=������������_______��
��2����NH3����ԭNOx���������������Ⱦ��
��֪��8NH3(g)+6NO2(g)![]() 7N2(g) +12H2O(l) ��H��0����ͬ�����£���2 L�ܱ������ڣ�ѡ�ò�ͬ�Ĵ������з�Ӧ������N2������ʱ��仯��ͼ��ʾ��
7N2(g) +12H2O(l) ��H��0����ͬ�����£���2 L�ܱ������ڣ�ѡ�ò�ͬ�Ĵ������з�Ӧ������N2������ʱ��仯��ͼ��ʾ��

���ڴ���A�������£�0��4 min��v(NH3) = _______��
�ڸ÷�Ӧ���Ea(A)��Ea(B)��Ea(C)�ɴ�С��˳����_______��������_______��
������˵����ȷ����_______�����ţ���
a��ʹ�ô���A��ƽ��ʱ����Hֵ����
b�������¶ȿ�ʹ������������ɫ����
c����λʱ�����γ�N-H����O-H������Ŀ���ʱ��˵����Ӧ�Ѿ��ﵽƽ��
d�����ں��ݾ��ȵ��ܱ������з�Ӧ����ƽ�ⳣ������ʱ��˵����Ӧ�Ѿ��ﵽƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʽṹ�й����ʺ��ص㣬�ش��������⣺
(1)Ti��̬ԭ�Ӻ���۵����Ų�ʽΪ____________����̬þԭ�Ӻ��������____________�ֲ�ͬ�Ŀռ��˶�״̬��
(2)�Ѵ�������ͬ�������壬����Ti�����������ܶѻ����¡�Ti�������������ѻ���������Tiת��Ϊ�¡�Ti�������____________(��������������������)��
(3)д����NH4+��Ϊ�ȵ������һ�ַ��Ӻ�һ�����ӵĻ�ѧʽ____________��____________��
(4)��ϩ��(CH2=CH-CN)������![]() ���������ĸ�����Ϊ____________��������̼ԭ�ӹ���ӻ�������____________��
���������ĸ�����Ϊ____________��������̼ԭ�ӹ���ӻ�������____________��
(5)��д��H��C��N��OԪ�ص縺���ɴ�С��˳��____________��
(6)����Na���۵㡢�е㶼�Ƚ���Mg�͵�ԭ����________________________��
(7)Cu��OԪ���γɵ�ij�ֻ�����ľ����ṹ��ͼ��ʾ����������ԭ�ӵ���λ��Ϊ___________���������ӵ�����ֵΪNA�������ı߳�Ϊapm���þ�����ܶ�Ϊ___________g��cm-3.

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ư����Ч�ɷ�����Ũ���ᷴӦ����Cl2��һ�ֹ���ʱ��������������ʵȡ����ͼ��ѡ���ʵ���ʵ��װ�ã����һ�����ʵ�飬�ⶨƯ����Ч�ɷֵ�����������


����д���пհף�
(1)ʵ����Ư����Ч�ɷ���Ũ���ᷴӦ�Ļ�ѧ����ʽΪ_______________________��
(2)��ѡ��װ�õ�����˳��Ӧ��(����ӿڵ���ĸ����)_______________��
(3)�ڶ�ȡ��Ͳ�Ŀ̶���ʱ��Ӧע��________________________________________________��
(4)�����������Բ���������Cl2����ⶨ�����___(�ƫ�ߡ�����ƫ�͡���Ӱ�족)����ԭ����____��
(5)ijͬѧ��ʵ���з�����Ͳ��δ�ռ���Һ�壬��ʧ�ܵ�ԭ������������е�________��
��װ��©������Ũ�����ѱ��ϡ���ᡡ����ѡ�����ݻ�̫��Ư����ȫ���ʡ���e��f����d��f
A���٢ڢ� B���٢ڢܢ� C���٢ڢۢ� D��ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2��Ϊһ�ֹ����͵�����������������ȡ��Cl2��Ϊ����ˮ������������֪ClO2��һ��������ˮ���������л��ܼ������壬��ͼ��ʵ���������Ʊ����ռ�һ�����ϴ�����ClO2��װ�ã�ijЩ�г�װ�ú͵����Ʒʡ�ԣ�������E��ʢ��CCl4Һ�壨���ڳ�ȥClO2�е�δ��Ӧ��Cl2����
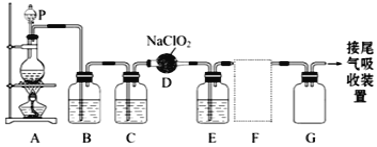
��1������P��������___��
��2��ʵ�����Ʊ�ClO2��ԭ�������������ƹ�����������Ӧ��д��D�з�����Ӧ�ķ���ʽ��___��
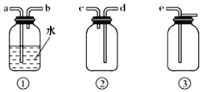
��3��Bװ������ʢ���Լ���___��
��4��FΪClO2�ռ�װ�ã�Ӧѡ�õ�װ����___������ţ���������Eװ�õ��������ĵ��ܿ���___����ӿ���ĸ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ĵ⻯��(Snl4��M=627g/mol)��һ�ֳ�ɫ��״���壬��ˮ����ˮ�⣬���ڷ�ˮ�ܼ�����Sn��l2ֱ�ӻ��ϵõ���ʵ��װ����ͼ(1)(����װ����ȥ)��ʾ��

ʵ�鲽�����£�
��װ����������ҩƷ��ͨ������ˮ������Բ����ƿ�����Ʒ�Ӧ�¶���80�����ң����ֻ���״̬��ֱ����Ӧ��ȫ��ȡ������A��B�����Ƚ���Һ���������ձ��У����ȵ�CCl4ϴ��Բ����ƿ�ڱں���Ƭ������ϴ��Һ�ϲ����ձ��ڡ��ٽ��ձ�������ˮԡ����ȴ������Snl4���塣
��ش��������⣺
(1)����B������Ϊ___________������ˮ�Ľ���Ϊ____________����������������������Ϊ�˿��Ʒ�Ӧ�¶ȣ���Բ����ƿ���˵ļ��ȷ�ʽ��____________________��
(2)����A��ʢ�ŵ��Լ�Ϊ��ˮCaCl2��������Ϊ____________��
(3)��Ӧ��ȫ������Ϊ__________�����ȵ�CCl4ϴ��Բ����ƿ�ڱں���Ƭ��Ŀ����_______�����ձ��л�ȡ��Ʒ�IJ�������Ϊ______________��
(4)��Ʒ�Ĵ��ȿ��õζ����ⶨ����ȡm g��Ʒ������������ˮ��ʹ��Ʒ���ˮ��[SnI4+(2+x)H2O=SnO2��xH2O��+4HI]�����ϲ���Һȫ��������250mL����ƿ�С���ȡ25.00mL����ƿ�У���������CCl4�ͼ���KSCN��Һ����c mol/L�ı�FeCl3��Һ�ζ����յ㣬ƽ�вⶨ���Σ�ƽ�����ı�FeCl3��Һ�����Ϊ1mL��(��֪��2Fe3++2I-![]() 2Fe2++I2)
2Fe2++I2)
�����й��ڵζ�����������ȷ����________��
a.ͼ(2)��Ϊ����ζ���©Һ��Ӧ����ʿ��Ϳ��������a�˺��������ڵ�c��
b.�ζ��ӽ��յ�ʱ���ζ��ܵļ�����ԽӴ���ƿ���ڱ�
c.���²���Һ��Ϊ�Ϻ�ɫ�Ұ���Ӳ���ɫ��Ϊ�ζ��յ�
d.������CCl4��������Ʒ�Ĵ��ȿ���ƫ��
�ڲ�Ʒ���ȵı���ʽΪ_________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com