
 有效地开发利用碳资源可适当解决能源危机.运用化学反应原理的相关知识研究碳及其化合物的性质.
有效地开发利用碳资源可适当解决能源危机.运用化学反应原理的相关知识研究碳及其化合物的性质.分析 (1)C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol①
C(s)+H2O(g)=CO(g)+H2(g)△H2=+131.3kJ/mol②
依据盖斯定律①-②得到CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g),依据热化学方程式和盖斯定律来计算得到;
(2)燃料电池中燃料在负极失电子发生氧化反应,氧气在正极得到电子发生还原反应,阳离子移向正极,阴离子移向负极;
(3)①固体质量增加3.2g,求出生成FeO的量,然后求出二氧化碳的变化量及反应速率;
②新平衡时CO物质的量增加,可判断平衡向正方向移动;
③浓度变化分析反应速率变化判断;
(4)Na2CO3溶液的浓度为7×10-4mol/L,等体积混合后溶液中c(CO32-)=3.5×10-4mol/L,根据Ksp=c(CO32-)•c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍.
解答 解:(1)C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol①
C(s)+H2O(g)=CO(g)+H2(g)△H2=+131.3kJ/mol②
依据盖斯定律①-②得到CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g),△H=-524.8KJ/mol;
故答案为:-524.8;
(2)用煤炭气(CO、H2)作燃气的燃料电池,以NaOH溶液做电解质制成.负极的电极反应式为:CO+H2-4e-+6OH-=CO32-+4H2O;则正极反应式为:O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-;负;
(3)①Fe(s)+CO2(g)?FeO(s)+CO(g)中Fe→FeO,固体质量增加3.2g为氧元素的质量,则氧元素的物质的量为0.2mol,说明生成FeO为0.2mol,所以消耗的二氧化碳为0.2mol,所以v(CO2)=$\frac{\frac{0.2mol}{2L}}{1min}$=0.1mol•L-1•min-1,速率之比等于化学方程式计量数之比,v(CO)=0.1mol•L-1•min-1,
故答案为:0.1mol•L-1•min-1;
②由于建立新平衡时CO物质的量增加,可知升高温度,平衡正向移动,说明正反应吸热,即△H>0;
平衡常数K=$\frac{c(CO)}{c(C{O}_{2})}$,由于一氧化碳的浓度增加,二氧化碳的浓度减小,所以平衡常数变大,即K1<K2;
故答案为:>;<;
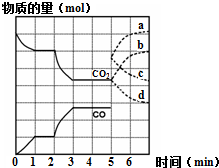
③充入CO,CO浓度增大,逆反应速率增大,之后逐渐减小;5min时CO2浓度不变,正反应速率不变,平衡逆向移动,CO2浓度增大,正反应速率逐渐增大;n(CO2)的物质的量从原平衡曲线逐渐增大;
故答案为:b;
(4)Na2CO3溶液的浓度为7×10-4mol/L,等体积混合后溶液中c(CO32-)=$\frac{1}{2}$×7×10-4mol/L=3.5×10-5mol/L,根据Ksp=c(CO32-)•c(Ca2+)=2.8×10-9可知,c(Ca2+)=$\frac{2.8×1{0}^{-9}}{3.5×1{0}^{-5}}$mol/L=8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×8×10-5mol/L=1.6×10-4mol/L,
故答案为:1.6×10-4mol/L.
点评 本题考查了化学平衡的影响因素、平衡状态的判断、反应速率的计算等,难度中等.随着反应进行变化的物理量不再变化,说明到达平衡.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 淀粉的最简式:CH2O | B. | 邻羟基苯甲酸的结构简式: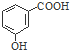 | ||
| C. | 2-乙基-1,3-丁二烯的键线式: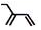 | D. | 苯分子球棍模型: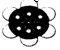 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ③ | ④ | ⑤ | |||||
| 3 | ① | ② | ⑥ | ⑦ | ⑧ | |||
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
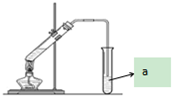 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: ,该反应类型为取代反应;该反应中浓硫酸的作用是催化剂和吸水剂;
,该反应类型为取代反应;该反应中浓硫酸的作用是催化剂和吸水剂;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| N2+3H2?2NH3 | ||||
| 温度 | 25℃ | 200℃ | 400℃ | 600℃ |
| 平衡常数K | 5×108 | 650 | 0.507 | 0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
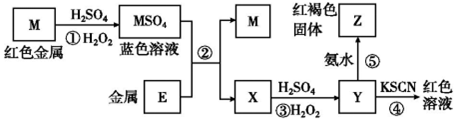
| A. | 在反应①中硫酸既表现了酸性、又表现了氧化性 | |
| B. | 我国是世界上最早使用反应②冶炼金属M的国家 | |
| C. | 在③反应中若不加稀硫酸可能看到红褐色沉淀 | |
| D. | 红褐色固体Z不能溶于氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
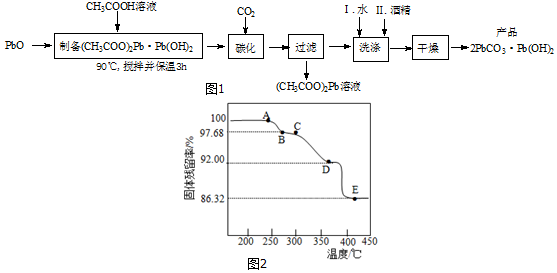
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com