
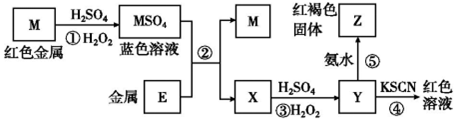
| A. | 在反应①中硫酸既表现了酸性、又表现了氧化性 | |
| B. | 我国是世界上最早使用反应②冶炼金属M的国家 | |
| C. | 在③反应中若不加稀硫酸可能看到红褐色沉淀 | |
| D. | 红褐色固体Z不能溶于氢氧化钠溶液 |
分析 由流程可知,红色金属M为Cu,发生Cu+H2O2+H2SO4=CuSO4+2H2O,蓝色溶液为CuSO4,结合红褐色固体Z为Fe(OH)3,则金属E为Fe,X为FeSO4,Y为Fe2(SO4)3,以此来解答.
解答 解:A.反应①发生Cu+H2O2+H2SO4=CuSO4+2H2O,S元素的化合价不变,只表现了酸性,故A错误;
B.反应②为湿法炼铜,我国是世界上最早使用冶炼金属Cu的国家,故B正确;
C.过氧化氢具有强氧化性,与硫酸亚铁发生氧化还原反应生成铁离子,在中性溶液中铁离子转化为沉淀,③反应中若不加稀硫酸可能看到红褐色沉淀,故C正确;
D.褐色固体Z为Fe(OH)3,与NaOH不反应,故D正确;
故选A.
点评 本题考查无机物的推断,为高频考点,把握金属及化合物的性质、发生的反应混合现象为解答关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:实验题
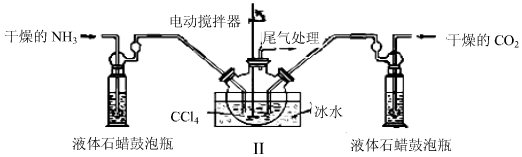
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有效地开发利用碳资源可适当解决能源危机.运用化学反应原理的相关知识研究碳及其化合物的性质.
有效地开发利用碳资源可适当解决能源危机.运用化学反应原理的相关知识研究碳及其化合物的性质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
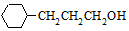 流程图如图
流程图如图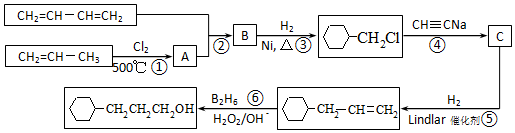
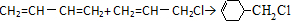 .
.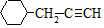 .
.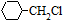 含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式
含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式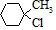 .
.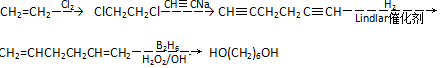 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| B. | 乙基对羟基的影响,使羟基的活性变弱,电离H+的能力不及H2O | |
| C. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 甲苯、苯与硝酸作用得到一硝基取代物的反应条件分别为30℃、50-60℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,32gO2和O3的混合气体中含有的氧原子数为2NA | |
| B. | 在常温常压下,11.2LN2含有的分子数为0.5NA | |
| C. | 0.5 mol•L-1MgCl2溶液中,含有Cl-个数为NA | |
| D. | 18 g NH4+中所含的电子数为11NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com