
| A、反应A(g)?2B(g);△H,若正反应的活化能为Ea kJ mol-1,逆反应的活化能为Eb kJ?mol-1,则△H=(Ea-Eb)kJ?mol-1 | ||
| B、标准状态下,将0.1 mol?L-1 的氨水溶液中加入少量氯化铵晶体,若混合溶液pH=7,则c(NH4+)=c(Cl-) | ||
| C、足量的锌铜合金与100mL pH=1 稀硫酸反应,反应3s 时测得pH=2,假设反应前后溶液的体积保持不变,则3s 内产生氢气的平均速率是33.6 mL?s-1 | ||
D、将浓度为0.1mol?L-1HF 溶液加水不断稀释过程中,电离度(α)和Ka(HF)保持不变,
|
(0.1-0.01)mol/L×0.1L×22.4L/mol×
| ||
| 2×3s |
(0.1-0.01)mol/L×0.1L×22.4L/mol×
| ||
| 2×3s |


科目:高中化学 来源: 题型:
| A、用福尔马林浸泡海鲜防止鱼虾变质 |
| B、用小苏打做发酵粉制面包 |
| C、二氧化硫可广泛用于食品的增白 |
| D、向乳制品中添加三聚氰胺以提高含氮量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钠溶液中滴入盐酸 |
| B、水中加入钠 |
| C、氨水中加入少量NH4Cl 固体 |
| D、醋酸溶液微热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.查看答案和解析>>
科目:高中化学 来源: 题型:
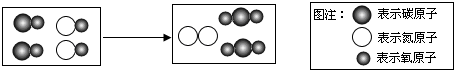
| A、图中单质的化学式为N2 |
| B、该反应使有毒气体转化为无毒气体 |
| C、反应物都属于氧化物 |
| D、反应中原子、分子个数都不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、①③ | B、②④ | C、①④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.8 g D2O含有NA个中子 |
| B、用5 mL 3 mol/L FeCl3溶液制成的氢氧化铁胶体中所含胶粒数为0.015 NA |
| C、在Na2O2与CO2的反应中,每转移NA个电子时,消耗22.4 L的CO2 |
| D、25℃时,7 g C2H4和C3H6的混合气体中,含有NA个C-H键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色溶液中:H+、Na+、I-、ClO- |
| B、pH=13的溶液:Na+、K+、SiO32-、CO32- |
| C、含有较多Ag+溶液:HCO3-、K+、Na+、Cl- |
| D、c(H+)=0.1 mol?L-1的溶液:Na+、NH4+、SO42-、S2O32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com