
 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.| m |
| n |
| 1 |
| 2 |
| 1 |
| 2 |
| m |
| V |
| m |
| n |
| 2.8L |
| 22.4L/mol |
| 0.5mol |
| 0.5L |


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
| A、用试管夹从试管底由下往上夹住距离管口约三分之一处,手持试管夹长柄末端,进行加热 |
| B、制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中 |
| C、把玻璃管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻璃管插入端,缓慢旋进塞孔中 |
| D、实验时不慎打破温度计水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合前一元酸HA的c(H+)=0.1 mol?L-1 |
| B、该混合溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
| C、HA在水溶液中的电离方程式:HA=H++A- |
| D、该混合溶液中:c(A-)+c(HA)=0.1 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
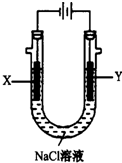
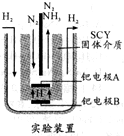 氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.| 1 |
| 2 |
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol.L-l) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
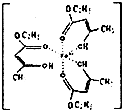 氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示.
氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应A(g)?2B(g);△H,若正反应的活化能为Ea kJ mol-1,逆反应的活化能为Eb kJ?mol-1,则△H=(Ea-Eb)kJ?mol-1 | ||
| B、标准状态下,将0.1 mol?L-1 的氨水溶液中加入少量氯化铵晶体,若混合溶液pH=7,则c(NH4+)=c(Cl-) | ||
| C、足量的锌铜合金与100mL pH=1 稀硫酸反应,反应3s 时测得pH=2,假设反应前后溶液的体积保持不变,则3s 内产生氢气的平均速率是33.6 mL?s-1 | ||
D、将浓度为0.1mol?L-1HF 溶液加水不断稀释过程中,电离度(α)和Ka(HF)保持不变,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
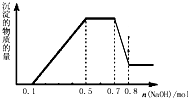 溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A、溶液中一定不含CO32-,可能含有SO42-和NO3- |
| B、在滴加NaOH溶液物质的量为0.5至0.7mol时,发生的离子反应为:Al3++4OH-=AlO2-+2H2O |
| C、溶液中的阳离子只有H+、Mg2+、Al3+ |
| D、n(H+):n(NH4+):n(Mg2+)=2:4:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com