
| A、碳酸钠溶液中滴入盐酸 |
| B、水中加入钠 |
| C、氨水中加入少量NH4Cl 固体 |
| D、醋酸溶液微热 |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
| A、1.09g |
| B、1.20 g |
| C、1.36g |
| D、1.63g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合前一元酸HA的c(H+)=0.1 mol?L-1 |
| B、该混合溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
| C、HA在水溶液中的电离方程式:HA=H++A- |
| D、该混合溶液中:c(A-)+c(HA)=0.1 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A-B | A=B | C-B | C=B | |
| 键能:/kJ?mol-1 | 360 | 803 | 464 | 640 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
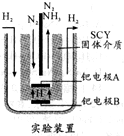 氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.| 1 |
| 2 |
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol.L-l) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应A(g)?2B(g);△H,若正反应的活化能为Ea kJ mol-1,逆反应的活化能为Eb kJ?mol-1,则△H=(Ea-Eb)kJ?mol-1 | ||
| B、标准状态下,将0.1 mol?L-1 的氨水溶液中加入少量氯化铵晶体,若混合溶液pH=7,则c(NH4+)=c(Cl-) | ||
| C、足量的锌铜合金与100mL pH=1 稀硫酸反应,反应3s 时测得pH=2,假设反应前后溶液的体积保持不变,则3s 内产生氢气的平均速率是33.6 mL?s-1 | ||
D、将浓度为0.1mol?L-1HF 溶液加水不断稀释过程中,电离度(α)和Ka(HF)保持不变,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
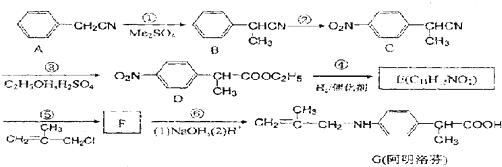
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com