
| A、1.09g |
| B、1.20 g |
| C、1.36g |
| D、1.63g |
| 1 |
| 2 |


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:
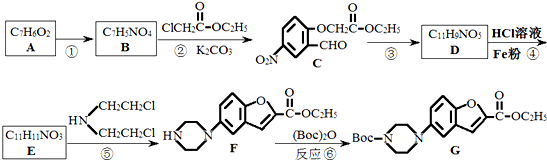
 ,请设计合成路线(无机试剂及溶剂任选).
,请设计合成路线(无机试剂及溶剂任选).| O2 |
| 催化剂 |
| CH3CH2OH |
| 浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
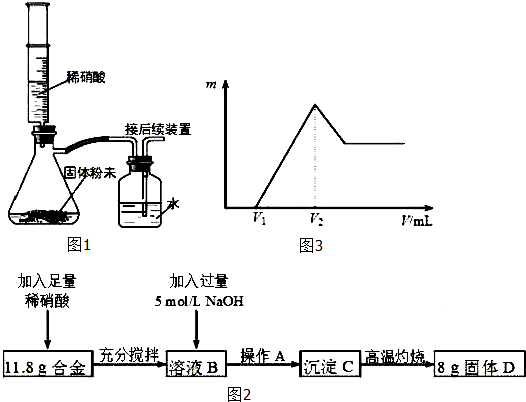
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | A(KMnO4溶液浓度/mol?L-1) | B(草酸溶液浓度/mol?L-1) | C(硫酸溶液浓度/mol?L-1) | 褪色时间/s |
| 1 | 3 | 3 | 1 | 336 |
| 2 | 1 | 2 | 3 | 82 |
| 3 | 3 | 1 | 3 | 76 |
| 4 | 1 | 3 | 2 | 133 |
| 5 | 2 | 3 | 3 | 102 |
| 6 | 3 | 2 | 2 | 156 |
| 7 | 2 | 2 | 1 | 300 |
| 8 | 2 | 1 | 2 | 115 |
| 9 | 1 | 1 | 1 | 200 |
| A(KMnO4溶液) | B(草酸溶液) | C(硫酸溶液) | |||||||
| 浓度/mol?L-1 | 0.005 | 0.010 | 0.015 | 0.1 | 0.5 | 0.9 | 6 | 12 | 18 |
| 平均褪色时间/s | 138.3 | 172.3 | 189.3 | 130.3 | 179.3 | 190.3 | 278.7 | 134.7 | 86.7 |
| c(H2SO4)/mol?L-1 | 18 | 16 | 14 | 12 | 10 | 8 | 6 |
| 褪色时间/s | 67 | 83 | 90 | 103 | 129 | 146 | 200 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向两份蛋白质溶液中分别滴加NaCl溶液和 CuSO4溶液.均有固体析出 | 蛋白质均发生了变性 |
| B | 取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化, 滴加KSCN溶液,溶液变为红色 | 该Fe(NO3)2试样已经 变质 |
| C | 将少量某物质的溶液滴加到新制的银氨溶液中, 水浴加热后有银镜生成 | 该物质一定属于醛类 |
| D | 同条件下,分别将0.1mol?L-1的盐酸和醋酸进 行导电性实验,与醋酸串联的灯泡较暗 | 醋酸是弱酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用福尔马林浸泡海鲜防止鱼虾变质 |
| B、用小苏打做发酵粉制面包 |
| C、二氧化硫可广泛用于食品的增白 |
| D、向乳制品中添加三聚氰胺以提高含氮量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钠溶液中滴入盐酸 |
| B、水中加入钠 |
| C、氨水中加入少量NH4Cl 固体 |
| D、醋酸溶液微热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com