
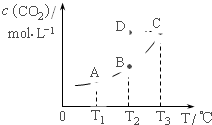
 在密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图.下列说法错误的是( )
在密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图.下列说法错误的是( )| A、平衡状态A与C相比,平衡状态A的c(CO)小 |
| B、在T2时,若反应处于状态D,则一定有V正<V逆 |
| C、反应CO(g)+H2O(g)?CO2(g)+H2(g) 的△H>0 |
| D、若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |


科目:高中化学 来源: 题型:
A、 称量氢氧化钠固体 |
B、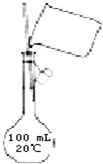 配制150mL0.10mol/L盐酸 |
C、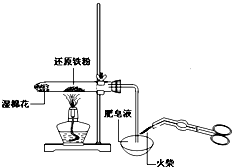 检验铁粉与水蒸气反应产生的氢气 |
D、 分离两种互溶但沸点相差较大的液体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3溶液与足量盐酸反应:CO32-+2H+═CO2↑+H2O |
| B、FeCl2溶液和Cl2反应:2Fe2++Cl2═2Fe3++2Cl- |
| C、钠与水反应:Na+H2O═Na++OH-+H2↑ |
| D、NaHCO3溶液与NaOH溶液:HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室里需要480 mL 2.0 mol?L-1的氢氧化钠溶液,配制溶液时先称量氢氧化钠固体38.4 g,然后再按照溶解、冷却、洗涤、定容、摇匀的步骤进行操作 |
| B、用标准盐酸滴定NaOH溶液测其浓度时,酸式滴定管用蒸馏水洗涤后,没用标准盐酸润洗,直接装标准盐酸滴定,所测的碱液浓度偏低 |
| C、蒸发硫酸铜溶液时蒸发皿放在石棉网上加热,并用坩埚钳夹取蒸发皿 |
| D、向氧氧化铁胶体中逐滴加入稀硫酸,先出现红褐色沉淀,继续滴加硫酸,沉淀溶解得到黄色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯水和SO2使品红溶液褪色及SO2可使酸性高锰酸钾溶液褪色的原理不同 |
| B、向某溶液中加入氯化钡溶液生成白色沉淀,再加稀硝酸,白色沉淀不消失该原溶液一定含有SO42- |
| C、用KSCN溶液鉴别FeCl2溶液、FeCl3溶液 |
| D、用氢氟酸雕刻玻璃,是由于氢氟酸能与二氧化硅反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煎炸食物的花生油和牛油都是可皂化的饱和酯类 |
| B、做衣服的棉和麻均与淀粉互为同分异构体 |
| C、制饭勺、饭盒、高压锅等的不锈钢是合金 |
| D、磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一.
(1)硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱式滴定管没有润洗会使测定含量偏低 |
| B、用移液管移取一定体积食醋时,应将移液管垂直放入稍倾斜的容器中,并将尖嘴贴紧容器 |
| C、该实验应用甲基橙作指示剂 |
| D、如果氢氧化钠溶液滴加过量,只能重新实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com