
【题目】一般情况下,下列比较中不正确的是 ( )
A. 键角:H2O< CO2 B. 键长:Cl—Cl>F—F
C. 键能:C—C<C—Si D. 强度:σ键>π键
科目:高中化学 来源: 题型:
【题目】M元素的1个原子失去2个电子转移到Y元素的2个原子中去,形成离子化合物Z.以下说法中错误的是( )
A.M形成+2价阳离子
B.Y形成+2价阳离子
C.Z可表示为MY2
D.Z的熔点较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一带一路”将为中国化工企业开辟新的国际市场,其中,能源、资源整合和环境治理是保驾护航的基础。
(1)下面是不同过程的热化学方程式,请写出FeO(s)被CO还原成Fe和CO2的热化学方程式_________________。
已知:Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1 ①
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1 ②
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1 ③
(2)贵金属的冶炼中往往会产生有毒气体,先进技术使用NaBH4为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式:___________________。
②在纳米钴的催化作用下,肼可以发生分解反应3N2H4 (g)![]() N2(g)+4NH3(g)
N2(g)+4NH3(g)
保持温度不变,向容积固定的容器中充入一定量的肼,下列描述能够说明体系处于平衡状态的是_________________
a.容器内压强不随时间改变
b.单位时间内生成amol N2的同时,生成4molNH3
c. N2H4 和NH3的物质的量之比保持不变的状态
d.混合气体的平均摩尔质量保持不变的状态
若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图所示,其中曲线b表示的是________(物质的化学式)的体积分数随温度的变化情况,为抑制肼的分解,可采取的合理措施有___________________(任写一种)。
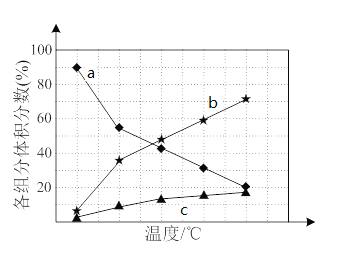
(3)大气污染气的主要成分是SO2和NO2。利用下图所示装置(电极均为惰性电极)可以吸收SO2,还可以用阴极排出的溶液吸收NO2。
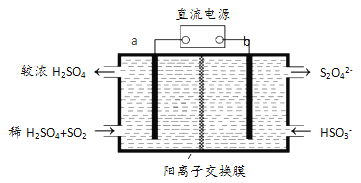
a极为 _________(填“阴”“阳”) b极的电极反应式为__________________。简述该装置能吸收SO2的原理:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2 min末该反应达到平衡,测得生成0.8 mol D, 0.4 mol C。下列判断不正确的是
xC(g)+2D(g)。2 min末该反应达到平衡,测得生成0.8 mol D, 0.4 mol C。下列判断不正确的是
A. x =1
B. 2 min时,A的浓度为0.9mol·L-1
C. 2 min内A的反应速率为0.3 mol·L-1·min-1
D. B的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置和操作能达到实验目的的是( )

A.实验Ⅰ:制取并收集氢气
B.实验Ⅱ:验证葡萄糖的还原性
C.实验Ⅲ:实验室制氨气并收集干燥的氨气
D.实验Ⅳ:检查碱式滴定管是否漏液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。难溶物在水中溶解达到饱和时,即建立沉淀溶解平衡,平衡常数称为溶度积(Ksp)。已知25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
(1)将浓度均为0.1mol/L的BaCl2溶液与Na2SO4溶液等体积混合,充分搅拌后过滤,滤液中c(Ba2+)=________mol/L。取100mL滤液与100mL2mol/LNa2SO4的溶液混合,混合液中c(Ba2+)= ______mol/L。
(2)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4 转化为CaCO3的离子方程式为___________________
②请分析CaSO4 转化为CaCO3的原理____________________
(Ⅱ)联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为_________________。
(2)①2O2(g)+N2(g)=N2O4(l) △H1
②N2(g)+2H2(g)=N2H4(l) △H2
③O2(g)+2H2(g)=2H2O(g) △H3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) △H4=-1048.9kJ/mol
上述反应热效应之间的关系式为△H4=________________,联氨和N2O4可作为火箭推进剂的主要原因为________________________。
(Ⅲ)某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。

(1)滴定
①用 _____式滴定管盛装0.1000 mol/L盐酸标准液,锥形瓶中装有25.00mL待测烧碱溶液。上图表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的标准盐酸的体积填入②表空格中。
②有关数据记录如下:
滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
滴定前 | 滴定后 | 消耗的体积 | ||
1 | 25.00 | 0.50 | 25.95 | 25.45 |
2 | 25.00 | _______ | _______ | ______ |
3 | 25.00 | 6.00 | 31.55 | 25.55 |
(2)根据所给数据,计算出烧碱样品的物质的量浓度。c = _________________。
(3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果 ________ ;
b.读数时,若滴定前仰视,滴定后俯视,则会使测定结果__________ ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com