
【题目】“一带一路”将为中国化工企业开辟新的国际市场,其中,能源、资源整合和环境治理是保驾护航的基础。
(1)下面是不同过程的热化学方程式,请写出FeO(s)被CO还原成Fe和CO2的热化学方程式_________________。
已知:Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1 ①
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1 ②
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1 ③
(2)贵金属的冶炼中往往会产生有毒气体,先进技术使用NaBH4为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式:___________________。
②在纳米钴的催化作用下,肼可以发生分解反应3N2H4 (g)![]() N2(g)+4NH3(g)
N2(g)+4NH3(g)
保持温度不变,向容积固定的容器中充入一定量的肼,下列描述能够说明体系处于平衡状态的是_________________
a.容器内压强不随时间改变
b.单位时间内生成amol N2的同时,生成4molNH3
c. N2H4 和NH3的物质的量之比保持不变的状态
d.混合气体的平均摩尔质量保持不变的状态
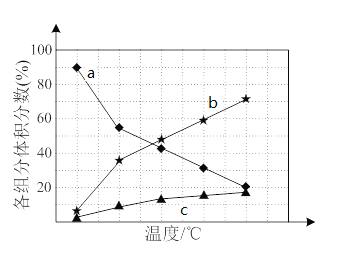
若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图所示,其中曲线b表示的是________(物质的化学式)的体积分数随温度的变化情况,为抑制肼的分解,可采取的合理措施有___________________(任写一种)。
(3)大气污染气的主要成分是SO2和NO2。利用下图所示装置(电极均为惰性电极)可以吸收SO2,还可以用阴极排出的溶液吸收NO2。
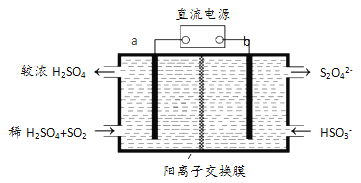
a极为 _________(填“阴”“阳”) b极的电极反应式为__________________。简述该装置能吸收SO2的原理:_____________________。
【答案】 FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH=-11 kJ·mol-1 2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O a c d NH3 降低反应温度或增加压强等 阳极 2HSO3- +2e- = S2O42-+2OH- 或2HSO3- +2e-+ 2H+ = S2O42-+2H2O SO2在 a极发生氧化反应,电极反应式:SO2-2e-+2H2O =4H++ SO42-,H+通过阳离子交换膜进入b 极室。
【解析】(1)Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),△H1=-25KJ/mol…①,3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g),△H2=-47KJ/mol…②,Fe3O4(s)+CO(g)═3FeO(s)+CO2(g),△H3=19KJ/mol…③,根据盖斯定律将方程式变形(3×①-②-2×③)÷6得:Fe(s)+CO(g)═Fe(s)+CO2(g),△H=(3×△H1-△H2-2×△H3)÷6=-11KJ/mol;
(2)①依据题意,反应物为Co2+与肼(N2H4)、碱性条件下存在OH-,生成物为:钴单质,据此得出Co的化合价降低,故N的化合价升高,只能为0价,即氮气,据此得出还有水生成,氧化还原反应中存在得失电子守恒以及元素守恒,故此反应的离子反应方程式为:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O;
②a.反应前后气体的化学计量数之和不等,混合气体的总物质的量随反应的进行不断变化,则容器内压强不随时间改变,说明是平衡状态,故a正确;b.单位时间内生成amol N2的同时,生成4molNH3,均为正反应速率,无法判断是平衡状态,故b错误;c. N2H4 和NH3的系数不等,当物质的量之比保持不变时,此反应为平衡状态,故c正确;d.混合气体的质量始终是定值,但混合气体的总物质的量不确定,当混合气体的平均摩尔质量保持不变,说明是平衡状态,故d正确;答案为acd;
图中曲线a的体积分数减小说明是反应物,b和c曲线对应的体积分数增大,说明是生成物,其中b的体积分数大于c,则b为NH3的体积分数;由图1可知,温度越高,肼的体积分数含量越低,故要抑制肼的分解,应降低反应温度,另外增大压强平衡也能逆向移动;
(3)依据图示可知,二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,即a为阳极,b为阴极区,HSO3-发生还原反应,电极反应式为2HSO3- +2e- = S2O42-+2OH- 或2HSO3- +2e-+ 2H+ = S2O42-+2H2O;该装置中SO2在a极发生氧化反应,电极反应式:SO2-2e-+2H2O =4H++ SO42-,H+通过阳离子交换膜进入b极室。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.水的离子积常数Kw只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C.常温下,向10 mL pH=3的CH3COOH溶液中加水稀释后,溶液中![]() 的值减小
的值减小
D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,![]() 的值增大
的值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是
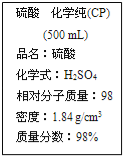
A. 该硫酸的物质的量浓度为9.2 mol/L
B. 1 mol Zn与足量该硫酸反应产生2 g氢气
C. 配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL
D. 该硫酸与等质量的水混合后所得溶液的浓度大于9.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 因为C—H为极性键,所以甲烷分子是极性分子
B. 因水分子间存在氢键,所以H2O分子比H2S更稳定
C. 用苯可以萃取溴水中的溴是因为Br2和苯都是非极性分子,易互溶且苯不溶于水
D. 卤化氢的沸点大小关系为HF<HCl<HBr<HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列装置或操作能达到实验目的的是________(填字母序号,下同)。

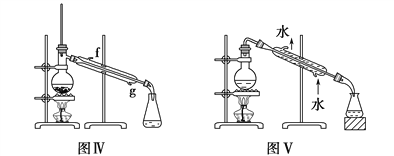
a.除去乙醇中的乙酸用图Ⅰ装置 b.形成原电池用图Ⅱ装置
c.制取乙酸乙酯用图Ⅲ装置 d.石油的蒸馏用图Ⅳ装置
e.分离Na2CO3溶液和CH3COOC2H5用图Ⅴ装置
(2)“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:
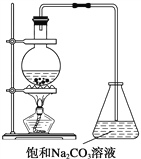
(1)写出制取乙酸乙酯的化学反应方程式____________。
(2)浓硫酸的作用是:
①_____________; ②_____________。
(3)做此实验时,还需向盛乙酸和乙醇的装置里加入几块碎瓷片,其目的是:____________________________。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是: __________________________________。
(5)用方程式表示为什么不能用NaOH溶液代替饱和Na2CO3溶液的原因:______。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是___________。
(7)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)_____________________。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一般情况下,下列比较中不正确的是 ( )
A. 键角:H2O< CO2 B. 键长:Cl—Cl>F—F
C. 键能:C—C<C—Si D. 强度:σ键>π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与实验相关的叙述错误的是( )
A.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的![]() ,液体也不能蒸干
,液体也不能蒸干
B.给试管中的液体加热时要不时移动试管,以免暴沸
C.可用稀硝酸鉴别MgI2、AgNO3、Na2CO3、NaAlO2四种溶液
D.稀释浓硫酸时,如果戴有防护眼罩,可以把水慢慢倒入装有浓硫酸的烧杯中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com