
【题目】下列装置和操作能达到实验目的的是( )

A.实验Ⅰ:制取并收集氢气
B.实验Ⅱ:验证葡萄糖的还原性
C.实验Ⅲ:实验室制氨气并收集干燥的氨气
D.实验Ⅳ:检查碱式滴定管是否漏液
科目:高中化学 来源: 题型:
【题目】关于垃圾的分类处理。下列说法错误的是
A. 废旧电池不可填埋焚烧,要单独处理
B. 填埋垃圾不需要处理,只要深埋即可
C. 包装纸、塑料、玻璃、织物等垃圾是可回收物
D. 剩饭菜和瓜果壳等生物性垃圾适于生化处理或堆肥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是
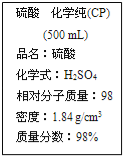
A. 该硫酸的物质的量浓度为9.2 mol/L
B. 1 mol Zn与足量该硫酸反应产生2 g氢气
C. 配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL
D. 该硫酸与等质量的水混合后所得溶液的浓度大于9.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列装置或操作能达到实验目的的是________(填字母序号,下同)。

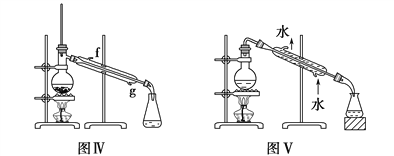
a.除去乙醇中的乙酸用图Ⅰ装置 b.形成原电池用图Ⅱ装置
c.制取乙酸乙酯用图Ⅲ装置 d.石油的蒸馏用图Ⅳ装置
e.分离Na2CO3溶液和CH3COOC2H5用图Ⅴ装置
(2)“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:
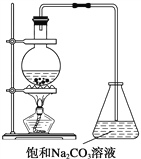
(1)写出制取乙酸乙酯的化学反应方程式____________。
(2)浓硫酸的作用是:
①_____________; ②_____________。
(3)做此实验时,还需向盛乙酸和乙醇的装置里加入几块碎瓷片,其目的是:____________________________。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是: __________________________________。
(5)用方程式表示为什么不能用NaOH溶液代替饱和Na2CO3溶液的原因:______。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是___________。
(7)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)_____________________。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一般情况下,下列比较中不正确的是 ( )
A. 键角:H2O< CO2 B. 键长:Cl—Cl>F—F
C. 键能:C—C<C—Si D. 强度:σ键>π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排放的废水中可能含有K+、Ag+、NH4+、Mg2+、SO42-、Cl-、NO3-、HCO3-等离子。经检测废水呈明显的碱性,则可确定该厂废水中肯定不含有的离子组合是( )
A. Ag+、K+、NO3-、HCO3- B. Ag+、NH4+、Mg2+、HCO3-
C. K+、NH4+、NO3-、SO42- D. K+、Mg2+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与实验相关的叙述错误的是( )
A.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的![]() ,液体也不能蒸干
,液体也不能蒸干
B.给试管中的液体加热时要不时移动试管,以免暴沸
C.可用稀硝酸鉴别MgI2、AgNO3、Na2CO3、NaAlO2四种溶液
D.稀释浓硫酸时,如果戴有防护眼罩,可以把水慢慢倒入装有浓硫酸的烧杯中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有五种可溶性物质A、B、C、D、E,它们所含阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、N![]() 、C
、C![]() 、X中的一种。
、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是________和________(填化学式)。
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质记为C,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕黄色沉淀,向该沉淀中滴入稀硝酸沉淀部分溶解,最后留有白色沉淀不再溶解。则X为________。
A.S![]() B.S
B.S![]()
C.CH3COO- D.Si![]()
(3)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀硫酸,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的________(填相应的离子符号),有关反应的离子方程式为_______________________。
(4)利用上述已经确定的物质,可以检验出D、E中的阳离子。请简述实验操作步骤、现象及结论:________________________ ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组以黄铜矿(主要成分CuFeS2)为原料进行如下实验探究,为测定黄铜矿中硫元素的质量分数,将m1g该黄铜矿样品放入如图所示装置中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铜矿样品。

(1)锥形瓶A内所盛试剂是________溶液;装置B的作用是________________;
锥形瓶D内发生反应的离子方程式为__________________________________。
(2)反应结束后将锥形瓶D中的溶液进行如下处理:

如图则向锥形瓶D中加入过量H2O2溶液反应的离子方程式为________________;
操作Ⅱ是洗涤、烘干、称重,其中洗涤的具体方法_________________________;
该黄铜矿中硫元素的质量分数为________(用含m1、m2的代数式表示)。
(3)反应后固体经熔炼、煅烧后得到泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO),要验证熔渣中存在FeO,应选用的最佳试剂是________。
A.KSCN溶液、氯水
B.稀盐酸、KMnO4溶液
C.稀硫酸、KMnO4溶液
D.NaOH溶液
(4)已知:Cu+在强酸性环境中会发生反应生成Cu和Cu2+,设计实验方案验证泡铜中是否含有Cu2O?
______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com