
【题目】工业上可由乙苯生产苯乙烯:![]() ,下列有关说法正确的是
,下列有关说法正确的是
A. 乙苯和苯乙烯均能发生取代反应、加聚反应和氧化反应
B. 用溴水可以区分苯乙烯和乙苯
C. 1 mol苯乙烯最多可与4 mol氢气加成,加成产物的一氯代物共有5种
D. 乙苯和苯乙烯分子中共平面的碳原子数最多都为7
【答案】B
【解析】
A.乙苯能发生取代反应、加成反应和氧化反应,不能发生加聚反应;而苯乙烯由于含有碳碳双键,所以能发生加聚反应和氧化反应,也能发生苯环上的取代反应,A错误;
B.苯乙烯能与溴水发生加成反应而是溴水褪色,而苯不能与溴水发生加成反应,因此不能使溴水因反应而褪色,故可以用溴水区分二者,B正确;
C.苯乙烯的苯环和碳碳双键都可以与H2发生加成反应,1 mol苯乙烯最多可与4 mol氢气加成,加成产物是乙基环己烷,在乙基环己烷分子中有6种不同的H原子,所以其一氯代物共有6种,C错误;
D.饱和C原子连接的四个原子构成的是四面体结构,通过该C原子最多还有2个原子在一个平面上,由于苯分子是平面分子,所以乙苯分子中的8个C原子可能在一个平面上;苯分子是平面分子,乙烯分子是平面分子,两个平面可能共平面,即8个C原子在一个平面上,所以共平面的碳原子数最多都为8,D错误;
故合理选项是B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,某反应达平衡,平衡常数K=c(CO).c(H2O)/[c(CO2).c(H2)]。保持容器容积不变,升高温度,H2浓度减小,则下列说法不正确的是
A. 该反应的焓变为正值
B. 恒温恒容下,再充入CO2气体,H2浓度一定减小
C. 升高温度,会使正反应速率增大,逆反应速率减小,平衡正移
D. 该反应化学方程式为CO2+H2![]() CO+H2O
CO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
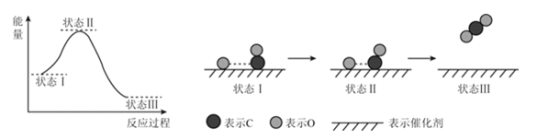
下列说法中正确的是
A. CO和O生成CO2是吸热反应 B. 在该过程中,CO断键形成C和O
C. CO和O生成了CO2 D. 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苦杏仁酸在医药工业可用于合成头孢羟唑、羟苄唑、匹莫林等的中间体,下列路线是合成苦杏仁酸及其衍生物的一种方法:

(1)试写出B的结构简式_____,C中官能团的名称为_____。
(2)反应①的反应类型为_____,D的核磁共振氢谱共有_____组峰。
(3)1molE最多可以与_____molNaOH反应。反应③的化学方程式为_____。
(4)两个C分子可以反应生成具有三个六元环的化合物F,则F的结构简式为_____。
(5)写出满足下列条件的C的同分异构体的结构简式_____。
A.既能发生银镜反应,又能发生水解反应
B.遇FeCl3能显紫色
C.苯环上具有两个位于对位的取代基
(6)已知:RCH2COOH![]() RCHClCOOH,请以冰醋酸为原料(无机试剂任选)设计制备聚乙醇酸(
RCHClCOOH,请以冰醋酸为原料(无机试剂任选)设计制备聚乙醇酸(![]() )的合成路线_____。
)的合成路线_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五种物质是①6gH2;②0.5molCO2;③1.204×1024个HCl;④147g硫酸;⑤92g乙醇(C2H5OH),它们的物质的量最大的是____,所含分子数最多的是____,含有原子个数最多的是___,质量最大的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应A(g)+3B(s) ![]() C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A. v(A)=2 mol·L-1·min-1 B. v(B)=1.2 mol·L-1·s-1
C. v(C)=0.1 mol·L-1·s-1 D. v(D)=0.4 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法中正确的是
A. 氢气的燃烧热为285.8 kJ·mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1
B. 等质量的硫蒸气和硫粉分别完全燃烧,后者放出的热量多
C. 某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目小于0.6×6.02×1023
D. 已知中和热为57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸溶液与含1 mol NaOH的溶液混合,放出的热量要小于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。

(1)由图中所给数据进行分析,该反应的化学方程式为 ;
(2)反应从开始至2分钟,用Z的浓度变化 表示的平均反应速率为v(Z)= ;
(3)2min反应达平衡容器内混合气体的平均相对分子质量比起始时 (填增大、减小或不变);混合气体密度比起始时 (填增大、减小或不变)。
(4)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n (X) = n (Y) = n (Z),则原混合气体中a : b = 。
(5)下列措施能加快反应速率的是 。
A.恒压时充入He
B.恒容时充入He
C.恒容时充入X
D.及时分离出Z
E.升高温度
F.选择高效的催化剂
(6)下列说法正确的是 。
A.升高温度改变化学反应的限度
B.已知正反应是吸热反应,升高温度平衡向右移动,正反应速率加快,逆反应速率减慢
C.化学反应的限度与时间长短无关 D.化学反应的限度是不可能改变的
E. 增大Y的浓度,正反应速率加快,逆反应速率减慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com