
����Ŀ���ӻ�������Ʊ�1��4�����������Ķ����������������йص�8����Ӧ�������������ﶼ����ȥ����

������3������ȡ����Ӧ��2��������ȥ��Ӧ��3�����ڼӳɷ�Ӧ��
��1������ȡ����Ӧ��______________�����ڼӳɷ�Ӧ��_______________���Ӧ��ţ���
��2��B��D�Ľṹ��ʽ�ֱ�Ϊ��B________________��D___________________��
��3��д����2���ķ�Ӧ����ʽ ________________________________________________ ��
��4�������ֲ�ͬ�Ļ��ţ��ֱ�Ϊ��X����Y����Z����ͬʱ�ֱ�ȡ�������ϵ�������ԭ�ӣ������ɵ�ͬ���칹����Ŀ�� _____________��
���𰸡� �٢ޢ� �ۢݢ� 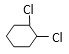
![]()
 10��
10��
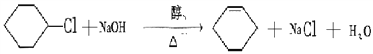
�����������������������Ҫ�����л���Ľṹ�����ʡ�
��1������ȡ����Ӧ�Ǣ٢ޢߣ����ڼӳɷ�Ӧ�� �ۢݢ���
��2��B�ǻ���ϩ�������ļӳɲ��D�Ǻ���̼̼˫�����������ǵĽṹ��ʽ�ֱ�Ϊ��B ��D
��D![]() ��
��
��3����2���ķ�Ӧ��±��������ȥ��Ӧ����ѧ����ʽΪ![]() ��
��
��4�������Ƚ���������X��Yȡ�������ϵ�������ԭ�ӣ��γ��ڡ��䡢�����ֽṹ���ٽ�����������Zȡ�������ϵ�һ����ԭ�ӣ������ɵ�ͬ���칹����Ŀ��10�֡�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������辧�����������״�ṹ����ṹ��ͼ��ʾ�����ڶ������辧�������˵������ȷ���ǣ�������
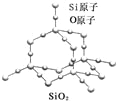
A. ������Si��Oԭ�Ӹ�����Ϊ1��2
B. ������Si��Oԭ������㶼����8���ӽṹ
C. ������һ����ԭ�Ӻ���Si��O����ĿΪ4
D. ��������С���ϵ�ԭ����Ϊ6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���÷�Һ©�����Է����һ��Һ���������(����)
A. ��ͱ� B. �Ҵ���ˮ C. ����CCl4 D. ���ͺ�ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����X��Y��Z���ֶ�����Ԫ�أ�ԭ�Ӱ뾶��С��ϵΪr(Y)>r(X)>r(Z)��ԭ������֮��Ϊ16��X��Y��Z����Ԫ�صij����������ʵ������¿ɷ�����ͼ�仯������B��C��Ϊ10���ӷ��ӡ�����˵���в���ȷ���ǣ� ��

A. X��Z�γɵ�ij�ֻ����������ɱ������ B. C��������B�У���Һ�ʼ���
C. Y��Z�γɵĶ�Ԫ������ֻ���м��Լ� D. A��C�ܷ���������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڿ������ȶ����ڵ���
A. ��������������Һ B. ������
C. �������� D. ��ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ի�����Ϊԭ�����������������ķ������������÷������Լ��ٻ�����Ⱦ�����Ϊ������ҵ�����÷���(��Fe2����Fe3���������μ�����CaO��MgO)�Ʊ��ߵ���������(Fe2O3)�ͻ���(NH4)2SO4�����������������£�

(1)�ڷ����ܽ����ʱ��Ӧѡ��________�ܽ�(����ĸ)��
A����ˮ B������������Һ C������ D������
(2) Ϊ����߷����Ľ�ȡ�ʣ��ɲ��õĴ�ʩ����Щ��_______________������д�����㣩��

(3)����A��һ������������ҵ�����ѡ��________(��ѡ��ʹ�õ��У�������Cl2��MnO2)����������_______________�����������з�����Ӧ�����ӷ���ʽΪ_________________��
(4)������ͼ�й����ݣ�����Ϊ��ҵ����������ʱӦ���Ƶ�����(���¶ȡ�pH������ʱ��������˵��)�ǣ�______________________________________________________��
(5) 炙������п��ܻ��е�������Fe(OH)3��________��
(6) 炙������Ļ�ѧʽ�ɱ�ʾΪ(NH4)xFey(SO4)z(OH)w���仯ѧʽ��ͨ������ʵ��ⶨ��
�� ��ȡһ����������Ʒ����ϡ�������ܽ⣬��������Һת��������ƿ�����Ƴ�100.00 mL��ҺA��
�� ��ȡ25.00 mL��ҺA�����������ữ��BaCl2��Һ��������ȫ�����ˡ�ϴ�ӡ����������أ��õ���ɫ����9.32 g��
�� ��ȡ25.00 mL��ҺA����������NaOH��Һ�����ȣ��ռ�����״��������448mL��ͬʱ�к��ɫ�������ɡ�
�� �����������ó������ˡ�ϴ�ӡ����գ����յù���4.80 g��
ͨ�����㣬��ȷ��炙������Ļ�ѧʽΪ___________________________������֪炙�������Ħ������Ϊ960gmol-1,��������в����ǹ�����ʧ�������ܽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ϊ����ѧ��Ӧԭ����ѡ��4����
��1��t��ʱ����2molSO2��1molO2ͨ�����Ϊ2L�ĺ��º����ܱ������У��������·�Ӧ��2SO2 (g)+O2(g)![]() 2SO3(g)����H��-196.6kJ��mol-1��2minʱ��Ӧ�ﵽ��ѧƽ��״̬����ʱ��÷�Ӧ��O2��ʣ��0.8mol����д���пհף�
2SO3(g)����H��-196.6kJ��mol-1��2minʱ��Ӧ�ﵽ��ѧƽ��״̬����ʱ��÷�Ӧ��O2��ʣ��0.8mol����д���пհף�
�� �ӷ�Ӧ��ʼ����ѧƽ��״̬������SO3��ƽ����Ӧ����Ϊ_____����ʱ��Ӧ��O2��ת������___________��
�� ����������֤���÷�Ӧ�Ѵﵽ��ѧƽ��״̬����______�����ţ���ͬ����
A��������ѹǿ���ٷ����仯
B. SO2������������ٷ����仯
C. ����������ԭ���������ٷ����仯
D. ��ͬʱ��������2nmol SO2��ͬʱ����n molO2
��t��ʱ������4mol SO2��2mol O2�Ļ������ͨ���������º����ܱ������У���Ӧ���´ﵽƽ��ʱSO2��ת������� �Ƚ�_______����������������������������С������
��2�����г����µ�������Һ��
��0.1mol/LFeC13 ��Һ��_______��������������������������������)��
�� ʵ����0.1mol/LNaHCO3��ҺpH>7����NaHCO3�ĵ���̶�_______ˮ��̶ȣ�������������������������С��������
�� ��0.10mol/L����ͭ��Һ�м�����������ϡ��Һ��ַ�Ӧ��dz��ɫ������ͭ�������ɣ�����Һ��pH=8ʱ��c(Cu2+)=_________����֪Ksp[Cu(OH)2]=2.2��10-2O����
��3������ʵ֤����ԭ����з����ķ�Ӧͨ���Ƿ��ȷ�Ӧ���������з�Ӧ�������Ϊԭ��ص���_________��
A. C(s)+H2O(g)=CO(g)+H2(g) ��H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ��H<0
C.2H2(g)+O2(g)=H2O(l����H<0
�� ��KOH��ҺΪ�������Һ��������ѡ��Ӧ���һ��ԭ��أ���������Ӧʽ��________��
�� ���ԭ���ڹ�ҵ�����Ź㷺��Ӧ�á���ͼ��ʾ�����У�aΪCuSO4��Һ��X��YΪ���Ե缫����Y�缫������Һ��pH�仯��_______��������������������������С������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ��Һ���ܴ��������һ��������
A. NH4+��CH3COO-��Na+��H+ B. AlO2-��Na+��K+��HCO3-
C. Mg2+��Na+��SO42-��NO3- D. ClO-��Na+��K+��Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. �¶ȡ�Ũ�ȡ�ѹǿ���������ܸı�ƽ�ⳣ��
B. �����¶ȣ�ƽ�ⳣ��һ������
C. ƽ�ⳣ���仯����ѧƽ�ⲻһ�������ƶ�
D. ��ѧƽ�ⷢ���ƶ���ƽ�ⳣ����һ���ı�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com