
【题目】在水溶液中能大量共存的一组离子是
A. NH4+、CH3COO-、Na+、H+ B. AlO2-、Na+、K+、HCO3-
C. Mg2+、Na+、SO42-、NO3- D. ClO-、Na+、K+、Fe2+
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】碱式碳酸铜是一种用途广泛的化工原料,明矾是种常见的净水剂,某校化学兴趣小组探究将一废弃矿石进行处理制备碱式碳酸铜和明矾,从而实现变废为宝。经查资料:该矿石成分为:Al2Fe4CuSi2O13,该化学小组制定工艺流程如下:

己知:Cu2+溶于足量的浓氨水中可形成铜氨溶液:Cu2++4NH3·H2O![]() Cu(NH3)42++4H2O
Cu(NH3)42++4H2O
回答下列问题:
(1)将Al2Fe4CuSi2O13改写成氧化物形式___________;
(2)为了步骤②提高酸浸速率,可采取措施有________,_________(任写两种);
(3)写出步骤⑥的离子方程式__________;
(4)用从滤渣2到明矾需先后加入_____、____两种试剂(按使用顺序填写化学式);
(5)在步骤⑦中,若先加K2CO3溶液,后加KOH溶液,则易发生
CuCO3(s)+2OH-(aq) ![]() Cu(OH)2(s)+CO32-(aq),则该反应平衡常数为:______。(已知:Ksp(CuCO3=2.4×10-10,Ksp(Cu(OH)2=2.2×10-20)。
Cu(OH)2(s)+CO32-(aq),则该反应平衡常数为:______。(已知:Ksp(CuCO3=2.4×10-10,Ksp(Cu(OH)2=2.2×10-20)。
(6)为了检验该碱式碳酸铜纯度,该小组称取25g样品,加入到100mL 3mol/L的盐酸中进行溶解。充分反应后,微热排除CO2,冷却后取出10mL,滴加2滴甲基橙,然后用2mol/L标准KOH溶液进行滴定,共用去5mL。则样品的纯度为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从环己烷可制备1,4—环己二醇的二醋酸酯。下面是有关的8步反应(其中所有无机物都已略去):

其中有3步属于取代反应,2步属于消去反应,3步属于加成反应。
(1)属于取代反应是______________,属于加成反应是_______________(填反应序号)。
(2)B、D的结构简式分别为:B________________,D___________________。
(3)写出第2步的反应方程式 ________________________________________________ 。
(4)有三种不同的基团,分别为—X、—Y、—Z,若同时分别取代苯环上的三个氢原子,能生成的同分异构体数目是 _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2、CH4和CO的混合气体在标准状况下的密度为1.25g/L,这三种气体的物质的量之比不可能为( )
A. 3:1:2 B. 6:2:3 C. 3:4:6 D. 9:3:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用接触法制5t98%的浓硫酸,在理论上需要含FeS2 75%(杂质不含硫元素)的硫铁矿为 ( )
A. 4.3t B. 8t C. 4t D. 5.6t
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 可用酸性高锰酸钾溶液检验丙烯醛中是否含有碳碳双键
B. 分子式为CH4O和C2H6O的物质一定互为同系物
C. 乙烯和苯都能与溴水发生反应而使其褪色
D. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图所示。
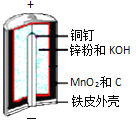
放电时总反应为:Zn + 2H2O + 2MnO2![]() Zn(OH)2 + 2MnOOH
Zn(OH)2 + 2MnOOH
从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下:
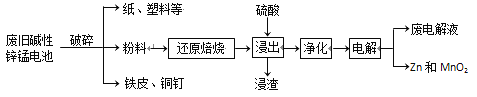
回答下列问题:
(1)MnOOH中,Mn元素的化合价为________。
(2)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),主要原因是“粉料”中含有________。
(3)“净化”是为了除去浸出液中的Fe2+,方法是:加入________(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+完全沉淀。(离子浓度小于1×10-5mol·L-1即为沉淀完全)已知浸出液中Mn2+、Zn2+的浓度约为0.1 mol·L-1,根据下列数据计算调节pH的合
理范围是________至________。
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
KSP近似值 | 10-13 | 10-17 | 10-38 |
(4)“电解”时,阳极的电极反应式为_____。本工艺中应循环利用的物质是_____(填化学式)。
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为________。
(6)某碱性锌锰电池维持电流强度0.5A(相当于每秒通过5×10-6 mol电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6 g,则电池失效时仍有________%的金属锌未参加反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会发展等息息相关。下列说法正确的是( )
A. 做衣服的棉、麻、丝绸灼烧有烧焦羽毛的气味
B. 糖尿病人应少吃含糖类的食品,可常喝糯米八宝粥
C. 现代工业生产中的芳香烃来源于石油的催化重整和煤的干馏
D. 豆浆中富含大豆蛋白,煮沸后蛋白质即水解生成氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式BaCO3 + 2H+ = CO2↑ + H2O + Ba2+ 中的H+不能代表的物质是( )
①HCl;②H2SO4;③HNO3;④NaHSO4;⑤CH3COOH
A.①③ B.①④⑤ C.②④⑤ D.①⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com