
【题目】某化学课外活动小组拟用铅蓄电池进行电絮凝净水的实验探究,设计的实验装置示意图如下。下列叙述正确的是
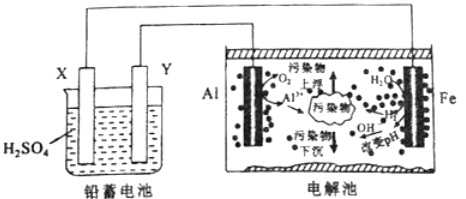
A.Y的电极反应为:Pb-2e-+SO42-=PbSO4
B.电解池内仅发生反应:2Al+6H2O=2Al(OH)3↓+3H2↑
C.若电解池阴极上有0.5mol H2生成,则铅蓄电池中消耗H2SO4为98g
D.用电絮凝法净化过的水,pH显著升高
【答案】C
【解析】
左端装置为电池,右端装置为电解池,根据电解池的装置图,铁电极上H2O转化成H2和OH-,铁电极为阴极,即Al电极为阳极,X为负极,Y为正极,据此分析。
A、根据上述分析,Y电极为正极,电极反应式为PbO2+SO42-+H++2e-=PbSO4+H2O,故A错误;
B、根据电解池装置,Al电极上除有Al3+生成外,还含有O2的生成,故B错误;
C、阴极上有0.5mol H2产生,铅蓄电池的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,即有H2~2e-~2H2SO4,即铅蓄电池中消耗硫酸的质量为0.5mol×2×98g/mol=98g,故C正确;
D、电解池内部发生的反应是2Al+6H2O![]() 2Al(OH)3↓+3H2↑,2H2O
2Al(OH)3↓+3H2↑,2H2O![]() 2H2↑+O2↑,净化过的水,pH基本保持不变,故D错误;
2H2↑+O2↑,净化过的水,pH基本保持不变,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】某黄酮类药物的合成涉及反应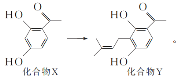 下列说法正确的是( )
下列说法正确的是( )
A.化合物X在空气中能稳定存在
B.化合物X中所有碳原子可处于同一平面
C.化合物X、Y都可与溴水发生加成反应
D.1mol化合物Y最多可以与4molH2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4NO3 溶液受热可发生分解反应:NH4NO3![]() N2↑+HNO3+H2O(未配平)。用 NA 表示阿伏加德罗数的值,下列说法正确的是
N2↑+HNO3+H2O(未配平)。用 NA 表示阿伏加德罗数的值,下列说法正确的是
A.分解时每生成 2.24 L(标准状况)N2,转移电子的数目为 0.6NA
B.2.8 g N2 中含有共用电子对的数目为 0.3NA
C.56 g Fe 与足量稀硝酸反应生成 NO2 分子的数目为 3NA
D.0.1 mol·L-1 NH4NO3 溶液中,NH4+的数目小于 0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,还可利用CO2据电化学原理制备塑料,既减少工业生产对乙烯的依赖,又达到减少CO2排放的目的。
(1)利用CO2和H2反应合成甲醇的原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
上述反应常用CuO和ZnO的混合物作催化剂。相同的温度和时间段内,催化剂中CuO的质量分数对CO2的转化率和CH3OH的产率影响的实验数据如下表所示:
ω(CuO)/% | 10 | 20 | 30 | 4b | 50 | 60 | 70 | 80 | 90 |
CH3OH的产率 | 25% | 30% | 35% | 45% | 50% | 65% | 55% | 53% | 50% |
CO2的转化率 | 10% | 13% | 15% | 20% | 35% | 45% | 40% | 35% | 30% |
由表可知,CuO的质量分数为________催化效果最佳。
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)![]() CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是(______)
CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是(______)
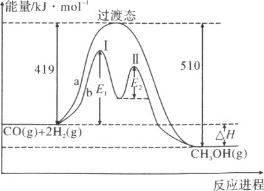
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(3)①在1L的恒定密闭容器中按物质的量之比1︰2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示,则压强P2________P1(填“>”、“<”或“=”);平衡由A点移至C点、D点移至B点,分别可采取的具体措施为________、________;在c点时,CO的转化率为________。
②甲和乙两个恒容密闭容器的体积相同,向甲中加入1molCO和2molH2,向乙中加入2molCO和4molH2,测得不同温度下CO的平衡转化率如图2所示,则L、M两点容器内压强:P(M)________2P(L);平衡常数:K(M)________K(L)。(填“>”、“<”或“=”)

(4)以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯![]() (简称LDPE)。
(简称LDPE)。
①电解时,阴极的电极反应式是________。
②工业上生产1.4×102kg的LDPE,理论上需要标准状况下________L的CO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
B.将大理石投入到足量盐酸中:CO32-+2H+=CO2↑+H2O
C.将Cl2通入KI溶液中:2I-+Cl2=2Cl-+I2
D.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3+ +3H2O![]() Fe (OH)3↓+ 3H+
Fe (OH)3↓+ 3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,A元素的原子有三个电子层,最外层上有一个电子;B元素负2价阴离子的电子层结构与氩原子相同;C元素的原子核内无中子;D原子核外电子数比A原子核外电子总数多6个。
(1)C与D形成化合物的化学式_______,其在水中的电离方程式为_______________。
(2)B离子的结构示意图_____________________。
(3)D元素在周期表中的位置_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制100mL1.0 mol/L Na2SO4溶液,正确的方法是( )
①将14.2 g Na2SO4,溶于100mL水中
②将32.2g Na2SO410H2O溶于少量水中,再用水稀释至100 mL
③将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL
A.①②B.②③C.①③D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗,其制备过程如图所示,下列叙述不合理的是( )

A.在反应②中,![]() 的作用可能是促进氯化铁水解
的作用可能是促进氯化铁水解
B.直接加热FeCl3溶液也可以得到四氧化三铁
C.反应③的化学反应方程式是6FeOOH+CO=2Fe3O4+3H2O+CO2
D.纳米四氧化三铁在水中形成的分散系,有可能产生丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的FeO,Fe,Fe3O4的混合物中加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现. 若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是()
A.11.2 gB.5.6 gC.2.8 gD.1.4g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com