
下列有关实验操作或现象中,正确的是( )
A.将新配制的0.1 mol·L-1的NaOH溶液转移到干燥、洁净、带橡胶塞的无色细口瓶中
B.向溶液中通入足量的氯气,以除去Fe2(SO4)3溶液中的FeSO4
C.在中和滴定实验过程中,目光应密切注视滴定管中的液面变化
D.称量NaOH质量时,应在天平的托盘上各放一张纸将NaOH放在纸上
科目:高中化学 来源: 题型:
工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程。

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)===3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)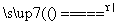 Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若________________,则整个装置气密性良好。装置D的作用是__________。装置E中为________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择________。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是__________________________。已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是__________________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有________。
a.烧杯 b.蒸发皿
c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:________________________________________。
已知Na2S2O3·5H2O遇酸易分解:S2O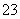 +2H+===S↓+SO2↑+H2O
+2H+===S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验可行的是( )
A.加入适量铜粉除去Cu(NO3)2溶液中的AgNO3杂质
B.用NaOH溶液除去CO2中混有的HCl气体
C.用浓硫酸与蛋白质的颜色反应鉴别各种蛋白质
D.用乙醇从碘水中萃取碘
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的做法不正确的是( )
A.分液时,分液漏斗中的上层液体应由上口倒出
B.用加热分解的方法区分碳酸钠和碳酸氢钠两种固体
C.配制0.100 0 mol·L-1氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流
D.检验NH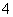 时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
间接碘量法测定胆矾中铜含量的原理和方法如下:原理:①在酸性条件下,Cu2+与I-作用可生成I2
②I2+I- I
I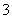 ③I
③I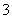 +2S2O
+2S2O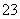
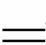 S4O
S4O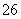 +3I-
+3I-
已知氧化性:Fe3+>Cu2+>I2>FeF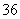 ,Fe3++6F-
,Fe3++6F-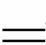 FeF
FeF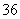
操作:准确称取a g胆矾试样[含少量Fe2(SO4)3],置于250 mL碘量瓶(带磨口塞的锥形瓶)中,加50 mL蒸馏水、5 mL 3 mol·L-1H2SO4溶液、少量NaF(足量),再加入足量的10% KI溶液,摇匀,盖上碘量瓶瓶盖,置于暗处5 min,充分反应后,加入指示剂,用c mol·L-1 Na2S2O3标准溶液滴定至终点,共用去V mL标准溶液。
回答下列问题:
(1)实验中,加KI前需加入少量NaF,其作用是______________________________。
(2)滴定实验中所用指示剂是________。
(3)本实验中用碘量瓶而不用普通锥形瓶的原因是____________________________。
(4)硫酸铜与碘化钾反应后,Cu2+被还原并生成白色的碘化亚铜沉淀,该反应的离子方程式为__________________。
(5)根据本次实验结果,该胆矾试样中铜元素的质量分数w(Cu)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
等体积硫酸铝、硫酸锌、硫酸钠溶液分别与足量的氯化钡溶液反应。若生成的硫酸钡沉淀的质量比为1︰2︰3,则三种硫酸盐溶液的物质的量浓度比为 ( )
A 1︰2︰3 B 1︰6︰9 C 1︰3︰3 D 1︰3︰6
查看答案和解析>>
科目:高中化学 来源: 题型:
聚合硫酸铁(PPS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原成Fe2+。实验步骤如下:
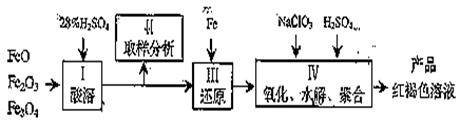
⑴ 用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有__________。
(a)容量瓶 (b) 烧杯 (c)烧瓶
⑵ 步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是____________________。
(a)控制溶液中Fe2+与Fe3+含量比 (b)确定下一步还原所需铁的量
(c)确定氧化Fe2+所需NaClO3的量 (d)确保铁的氧化物酸溶完全
⑶ 聚合硫酸铁溶液中SO42—与Fe3+物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42—与Fe3+物质的量之比。测定时所需的试剂______________。
(a)NaOH (b)FeSO4 (c)BaCl2 (d)NaClO3
⑷需要测定__________和_________的质量(填写化合物的化学式)。
⑸选出测定过程中所需的基本操作_____________(按操作先后顺序列出)。
(a)萃取、分液(b)过滤、洗涤(c)蒸发、结晶 (d)冷却、称量(e)烘干或灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:
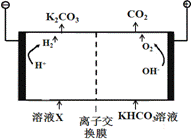
在阳极区发生的反应包括 和H ++ HCO3- == H2O + CO2↑。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
H2(g) + 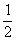 O2(g) === H2O(g) Δ H1= —242 kJ·mol-1
O2(g) === H2O(g) Δ H1= —242 kJ·mol-1
CH3OH(g) +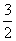 O2(g) === CO2 (g) + 2 H2O(g) Δ H2= —676 kJ·mol-1
O2(g) === CO2 (g) + 2 H2O(g) Δ H2= —676 kJ·mol-1
① 写出CO2和H2生成气态甲醇等产物的热化学方程式 。
② 下面表示合成甲醇的反应的能量变化示意图,其中正确的是 (填字母序号)。
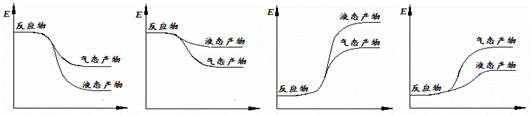
a b c d
(3)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如下:
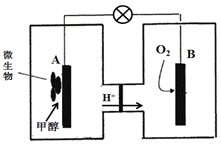
①该电池外电路电子的流动方向为 (填写“从A到B”或“从B到A”)。
②A电极附近甲醇发生的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com