
工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程。

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)===3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)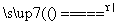 Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若________________,则整个装置气密性良好。装置D的作用是__________。装置E中为________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择________。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是__________________________。已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是__________________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有________。
a.烧杯 b.蒸发皿
c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:________________________________________。
已知Na2S2O3·5H2O遇酸易分解:S2O +2H+===S↓+SO2↑+H2O
+2H+===S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液。
(1)液柱高度保持不变 防止倒吸 NaOH(合理答案均可)
(2)2∶1
(3)c 控制滴加硫酸的速度(合理即可得分) 溶液变澄清(或浑浊消失) a、d
(4)取少量产品溶于足量稀盐酸,静置,取上层溶液(或过滤、取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质(合理答案均可)
[解析] (1)若装置气密性良好,则装置B中的长颈漏斗加入水,B瓶内压强变大,在长颈漏斗的颈中会形成一段液柱,且液柱高度保持不变;根据装置图可知装置D是安全瓶,可防止E中液体倒吸进入C中;装置E是用来吸收未反应完全的H2S或SO2的尾气处理装置,因此E中试剂需用碱溶液,如NaOH溶液。(2) 反应(Ⅰ)×2+反应(Ⅱ)+ 反应(Ⅲ)×3可得该转化过程的总反应:2Na2S+Na2SO3+3SO2===3Na2S2O3,则C瓶中Na2S和Na2SO3的物质的量之比最好为2∶1。(3)为减少SO2的损失,装置B中液体最好是饱和亚硫酸氢钠溶液;可通过控制滴加浓硫酸的速率来减慢SO2的产生速率从而达到减慢SO2的进入烧瓶C的实验要求;烧瓶C中反应达到终点,溶液中的硫全部转化为Na2S2O3,溶液由浑浊变澄清;烧杯、锥形瓶加热时需垫石棉网,蒸发皿、试管可直接用酒精灯加热。(4)为检验产品中是否含有Na2SO4,可取少量产品溶于足量盐酸,以排除溶液中SO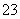 (包含S2O
(包含S2O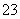 与盐酸反应生成的SO
与盐酸反应生成的SO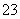 ),然后取上层清液,滴加BaCl2溶液,看是否有白色沉淀,得出上层清液中是否含有SO
),然后取上层清液,滴加BaCl2溶液,看是否有白色沉淀,得出上层清液中是否含有SO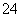 的结论,进而做出产品中有无Na2SO4杂质的判断。
的结论,进而做出产品中有无Na2SO4杂质的判断。


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
下列有关物质分类或归类不正确的是( )
A.混合物:盐酸、生铁、空气 B.化合物:烧碱、纯碱、氧化镁
C.盐:食盐、生石灰、石灰石 D.单质:石墨、臭氧(O3)、水银
查看答案和解析>>
科目:高中化学 来源: 题型:
为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMn04溶液 | 洗气 |
| B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 蒸馏 |
| D | C2H5OH (H2O) | 新制生石灰 | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物与生产、生活关系密切。
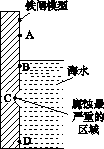
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为________。
②图中A、B、C、D四个区域,生成铁锈最多的是________(填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
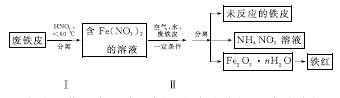
①步骤Ⅰ若温度过高,将导致硝酸分解。硝酸分解的化学方程式为______________________________。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O===2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为____________________________。
③上述生产流程中,能体现“绿色化学”思想的是______(任写一项)。
(3)已知t ℃时,反应FeO(s)+CO(g)Fe(s)+CO2(g)的平衡常数K=0.25。
①t ℃时,反应达到平衡时n(CO)∶n(CO2)=________。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x mol CO, t ℃时反应达到平衡。此时FeO(s)转化率为50%,则x=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制备下列气体时,所用方法正确的是( )
A.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置
B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体
C.制乙烯时,用排水法或向上排空气法收集气体
D.制二氧化氮时,用水或NaOH溶液吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 浓盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③ B.①④ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 | 叙述I | 叙述II |
| A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
| D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作或现象中,正确的是( )
A.将新配制的0.1 mol·L-1的NaOH溶液转移到干燥、洁净、带橡胶塞的无色细口瓶中
B.向溶液中通入足量的氯气,以除去Fe2(SO4)3溶液中的FeSO4
C.在中和滴定实验过程中,目光应密切注视滴定管中的液面变化
D.称量NaOH质量时,应在天平的托盘上各放一张纸将NaOH放在纸上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com