
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 | 叙述I | 叙述II |
| A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
| D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
科目:高中化学 来源: 题型:
工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程。

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)===3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)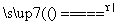 Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若________________,则整个装置气密性良好。装置D的作用是__________。装置E中为________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择________。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是__________________________。已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是__________________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有________。
a.烧杯 b.蒸发皿
c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:________________________________________。
已知Na2S2O3·5H2O遇酸易分解:S2O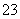 +2H+===S↓+SO2↑+H2O
+2H+===S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )
| 物质 组别 | 甲 | 乙 | 丙 |
| A | Al | HCl | NaOH |
| B | NH3 | O2 | HNO3 |
| C | SiO2 | NaOH | HF |
| D | SO2 | Ca(OH)2 | NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是
| 选项 | X | Y |
| A | SO2 | H2S |
| B | Cl2 | CO2 |
| C | NH3 | CO2 |
| D | SO2 | Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
溴主要以Br-形式存在于海水中,海水呈弱碱性。工业上制备的Br2的操作步骤为:
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
27.Cl2氧化Br-应在 条件下进行,目的是为了避免
28.Br2可用热空气吹出,其原因是
29.写出步骤③所发生的化学反应方程式。
用硫酸而不用盐酸酸化的原因可能是 。步骤②的产品有时运输到目的地后再酸化,主要是因为
30.为了除去工业Br2中微量的Cl2,可向工业Br2中
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验可行的是( )
A.加入适量铜粉除去Cu(NO3)2溶液中的AgNO3杂质
B.用NaOH溶液除去CO2中混有的HCl气体
C.用浓硫酸与蛋白质的颜色反应鉴别各种蛋白质
D.用乙醇从碘水中萃取碘
查看答案和解析>>
科目:高中化学 来源: 题型:
聚合硫酸铁(PPS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原成Fe2+。实验步骤如下:
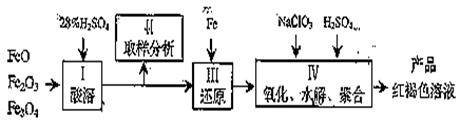
⑴ 用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有__________。
(a)容量瓶 (b) 烧杯 (c)烧瓶
⑵ 步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是____________________。
(a)控制溶液中Fe2+与Fe3+含量比 (b)确定下一步还原所需铁的量
(c)确定氧化Fe2+所需NaClO3的量 (d)确保铁的氧化物酸溶完全
⑶ 聚合硫酸铁溶液中SO42—与Fe3+物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42—与Fe3+物质的量之比。测定时所需的试剂______________。
(a)NaOH (b)FeSO4 (c)BaCl2 (d)NaClO3
⑷需要测定__________和_________的质量(填写化合物的化学式)。
⑸选出测定过程中所需的基本操作_____________(按操作先后顺序列出)。
(a)萃取、分液(b)过滤、洗涤(c)蒸发、结晶 (d)冷却、称量(e)烘干或灼烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com